[广东]2013届广东省肇庆市高三第一次模拟考试理综化学试卷
下列说法正确的是
| A.氨基酸和蛋白质既能与酸反应又能与碱反应 |
| B.在米汤中加入食盐,可以检验食盐中是否加碘 |
| C.“酸雨”是由大气中的碳、硫、氮的氧化物溶于雨水造成 |
| D.蔗糖、麦芽糖、淀粉和纤维素都能水解,最终水解产物都为葡萄糖 |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.稀硝酸中加入过量铁粉: Fe + 4H++ NO3-=Fe3++ NO↑ + 2H2O |
| C.用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
D.苯酚钠溶液中通入少量CO2: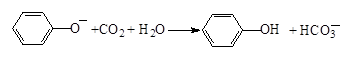 |
设NA为阿伏加德罗常数的数值,则下列叙述正确的是
| A.1 mol氨基(—NH2)中含电子数为10NA |
| B.标准状况下,2.24 L18O2中所含中子的数目是2NA |
| C.标准状况下,22.4 L C8H18中含有的共价键键数为25NA |
| D.在反应CaO + 3C = CaC2 + CO↑中,每生成1 mol CO,转移的电子数为3NA |
下列陈述I、II均正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
Fe3+有氧化性 |
铁盐可用作净水剂 |
| B |
SiO2是两性氧化物 |
SiO2可和HF反应 |
| C |
Al2O3的熔点很高 |
Al2O3可用作耐火材料 |
| D |
SO2有漂白性 |
SO2可使高锰酸钾溶液褪色 |
关于常温下pH = 12的NaOH溶液,下列说法错误的是
| A.c(OH-) =c(Na+) + c(H+) |
| B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.与等体积pH = 2的醋酸混合后所得溶液显碱性 |
| D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)> c(NH4+) |
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.图①表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| B.图②表示向乙酸溶液中通入氨气至过量的过程,溶液导电性的变化 |
| C.图③表示在1 L 1 mol/L FeBr2溶液中通入Cl2时Br-的量的变化 |
| D.图④表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸的物质的量的关系 |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象与结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 H2SO4溶液 |
试管口出现红棕色气体。则溶液中NO3-被Fe2+还原为NO2 |
| B |
向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 |
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀。说明样品溶液中一定含有SO42- |
| C |
向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 |
红色加深。说明盐类水解是吸热反应 |
| D |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 |
无砖红色沉淀生成。表明淀粉没有水解生成葡萄糖 |
关于下列装置说法正确的是 
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Sn,Sn为正极有气泡生成 |
香豆素类化合物具有抗病毒、抗癌等多种生物活性。香豆素-3-羧酸可由水杨醛制备。
(1)中间体X的化学式为 。
(2)水杨醛发生银镜反应的化学方程式为 。
(3)香豆素-3-羧酸在NaOH溶液中彻底水解生成的有机物的结构简式为 。
(4)下列说法错误的是
| A.中间体X不易溶于水 |
| B.水杨醛分子中所有原子一定处于同一平面 |
| C.水杨醛除本身外,含有苯环且无其它环的同分异构体还有4种 |
| D.水杨醛和香豆素-3-羧酸都能使酸性高锰酸钾溶液褪色 |
(5)反应①中的催化剂“哌啶”可以由“吡啶”合成,其反应为:
已知吡啶为环状,性质与苯类似。则吡啶的结构简式为 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 : 。
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g) △H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线(并作相应标注)。
铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2]-。含铜最丰富的天然资源是黄铜矿(CuFeS2)。
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高。其主要流程如下:
①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2 + FeCl3 = +4 + 2S。
②写出反应Ⅳ中发生反应的离子方程式:
。
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
。
④已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu。则反应Ⅴ所得溶液A中含有的溶质有 。
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。与上面湿法冶炼技术方法比较,新方法的优点是 、 。
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号