[上海]2013年初中毕业升学考试(上海卷)化学
是水质监测的重要指标之一,下列水样酸性最强的是()
| A. | 的工业废水 | B. | 的雨水 |
| C. | 的蒸馏水 | D. | 的矿泉水 |
右图为市售盐酸标签的部分内容,其中36.0%~38.0%表示该盐酸中

在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有 。若该物质通过化合反应生成。反应物除了 外,还有1. 2. 3. 4. 中的()
| A. | 一种 | B. | 两种 | C. | 三种 | D. | 四种 |
下图是某化学反应的示意图(
与
分别代表不同元素原子),该反应可能为
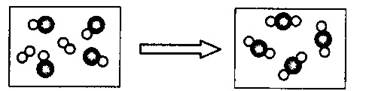
X可以发生如下反应:1. X+酸====盐+水;2. X+非金属氧化物======盐+水。X可能是
| A.氧化铜 | B.盐酸 | C.氢氧化钠 | D.碳酸钠 |
室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液()
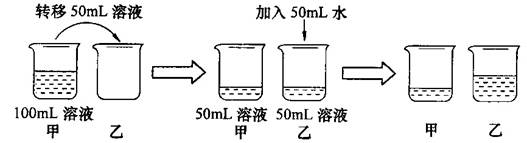
| A. | 溶质质量相同 | B. | 溶质质量分数相同 |
| C. | 均为不饱和溶液 | D. | 溶剂质量相同 |
关于分子和原子两种微粒的叙述正确的是()
| A. | 物质只能由分子构成 | B. | 相同原子可能构成不同的分子 |
| C. | 分子质量一定大于原子质量 | D. | 化学变化中分子数目一定发生变化 |
人类常从矿石中获取金属材料。
(1)铁是冶炼最多的金属。工业炼铁主要反应的化学方程式是:
,反应中的氧化剂是
(2)铜是人类利用较早的金属,木炭与氧化铜反应生成二氧化碳的化学方程式是
(3)铝在现代生活中得到广泛的应用。炼铝原料水铝石的主要成分是
,
由
(4)金属冶炼通常使矿石中金属元素转变为
某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验。
在甲乙丙三个烧杯中放入20
硝酸钾晶体,再分别加入50.0
冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。

(1)甲烧杯中溶液是
(2)由以上实验可得出结论:影响物质溶解度的因素有
(3)将乙烧杯中的溶液降温到
时,硝酸钾的溶解度是
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。

(5)分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时
(6)请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
| 温度 |
溶解度(
水) |
| 20 |
31.6 |
| 40 |
63.9 |
| 50 |
145 |
| 60 |
110 |
| 70 |
140 |
| 80 |
169 |
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。

| 实验编号 | 容器I | 针筒I | 容器II | 针筒II | 红墨水液面位置 |
| 二氧化碳(充满) | 10 澄清石灰水 | 二氧化碳(充满) | 10 水 | 保持左高右低 | |
| 0.55 锌 | 15 盐酸 | 0.24 镁 | 15 盐酸 |
(1)实验开始前红墨水左右两端液面保持相平。容器I、II体积相同,装置气密性良好。
(2)实验
中,容器I内产生的现象是
(3)实验
中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是
(4)红墨水的位置变化情况是
某大理石样品(所含杂质不溶于水且不与酸反应)与足量的盐酸充分反应,过滤后将绿叶蒸干,冷却后称量所得氯化钙固体,相关实验数据如下图所示(不计损耗):

(1)氯化钙的质量为g。
(2)计算该大理石样品中碳酸钙的物质的量(根据化学方程式列式计算)。
气体制取是重要的化学实验活动。
实验室用双氧水与二氧化锰制取氧气,该方法制取氧气的化学方程式是。能收集氧气的装置是(填编号)

要得到干燥的氧气,可将制得的气体通过填充一种氧化物的干燥装置,该氧化物是。
实验室制备二氧化碳时,要求能随时控制反应进行或停止,以下符合该条件的发生装置是(填编号)

用所选装置制备二氧化碳,能用于添加液体的仪器名称是,能使反应暂时停止的实验操作是.实验不适宜用排水集气法收集二氧化碳的理由是.
某溶液中可能含有碳酸钠、硫酸钠、氯化钾、盐酸中的一种或几种,为测定其成分,进行如下实验。
第一步:取样,进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色。
第二步:另取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的物质的量与时间的关系如下图所示。
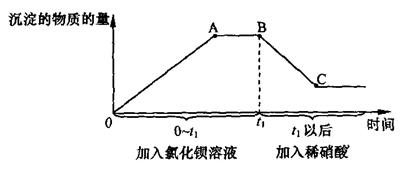
(1)由上述实验可知,原溶液中一定含有碳酸钠、硫酸钠和.
(2)第二步实验中,
之间图像所对应的溶液中的溶质一定有.
(3)
段减少的沉淀是.
(4)
点沉淀的物质的量为
点沉淀的物质的量的三分之一。原溶液中碳酸钠的物质的量(
)与硫酸钠的物质的量(
)的关系为
。




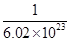
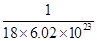
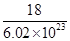
 粤公网安备 44130202000953号
粤公网安备 44130202000953号