高考化学易错题专题四 化学反应原理
Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
| A.[Na+]>[S2-]>[OH-]>[HS-]>[H+] |
| B.[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C.[Na+]==[HS-]+2[H2S]+2[S2-] |
| D.[OH-]==[H+]+[HS-]+[H2S] |
将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
| A.NaOH溶液 | B.蒸馏水 | C.Na2SO3溶液 | D.KI溶液 |
若室温时,pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则氨水的电离度可表示为( )
| A.10(12-a-b)% | B.10(a+b-14) | C.10(a+b-12)% | D.10(14-a-b) |
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
| A.溶液中钡离子数目减小 |
| B.溶液中钡离子浓度减小 |
| C.溶液中氢氧根离子浓度增大 |
| D.pH值减小 |
同温下两种稀碱水溶液,碱甲溶液的物质的量浓度为c1,电离度为a1;碱乙溶液的量浓度为c2,电离度为a2,已知甲溶液的pH值小于乙溶液的pH值,下列有关叙述正确的是( )
| A.c1>c2 | B.a1<a2 | C.碱性:甲<乙 | D.无法判断 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是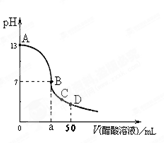
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
弱酸HY溶液的pH=3,弱酸HZ溶液的pH=4,两者浓度相近,将两溶液等体积混合后的pH范围是
| A.3.0~3.3 | B.3.3~3.5 | C.3.5~4.0 | D.3.7~4.3 |
25°C时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH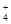 )与c(SO
)与c(SO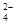 )之比是 ( )
)之比是 ( )
| A.等于2∶1 | B.大于 2∶1 | C.小于2∶1 | D.无法判断 |
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(气)+B(气)2C(气)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是:
| |
X |
Y |
| A |
温度 |
混合气体平均相对分子质量 |
| B |
压强 |
B的浓度 |
| C |
再加入A |
B的转化率 |
| D |
再加入C |
A的质量分数 |
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是:①生成物的质量分数一定增加;②生成物产量一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用催化剂
| A.①②③ | B.③④⑤ | C.②⑤ | D.④⑥ |
常温下,某溶液中水电离出的[OH-]=1×10-11mol·L-1,则该溶液不可能是:
| A.NaOH溶液 |
| B.NaHSO4溶液 |
| C.NH4Cl溶液 |
| D.0.001mol·L-1的CH3COOH溶液 |
下列事实不能用勒沙特列原理解释的是
| A.往H2S溶液中加碱,有利于S2-增多 |
| B.500℃左右比室温更利于氨的合成 |
| C.使用V2O5作催化剂可加快SO2转化为SO3的速率 |
| D.醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率 |
金属镁和0.1mol·L-1的HCl反应制取氢气,反应速率过快不易收集。为了减缓反应速率,又不减少产生氢气的量,加入下列试剂不能达到上述要求的是
| A.硫酸钠溶液 | B.醋酸钠固体 |
| C.碳酸钠固体 | D.水 |
质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。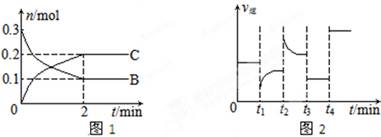
下列有关说法正确的是( )
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲 中C的浓度是乙中C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积 分数是甲中C 的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反 |
应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
下列关于四个图像的说法正确的是 ( )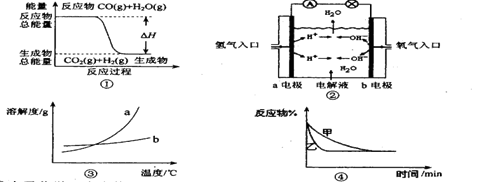
| A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H大于0 |
| B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1 |
| C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a |
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图1-14-1所示,请回答:
(1)“0”点导电能力为0的理由______。
(2)a,b,c三点溶液的pH值由小到大的顺序为______。
(3)a,b,c三点中电离度最大的是:______。
(4)若使c点溶液中[CH3COO-]增大,溶液的pH值也增大,可采取的措施为:
①______;②______;③______。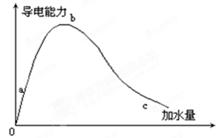
某温度下,一定量的混合气体在密闭容器中发生如下反应:mA(气)+nB(气)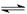 pC(气)达平衡后,将气体体积缩小到原来的
pC(气)达平衡后,将气体体积缩小到原来的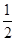 ,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
某温度下,向某密闭容器中加入1mol氮气和3mol氢气,使之反应合成氨,平衡后,测得氨的体积分数为m。若温度不变,只改变起始加入量,使之反应重新达平衡后,氨的体积分数仍然为m。若氮气、氢气和氨的加入量用x,y,z表示,应满足:
(1)温度、体积恒定时:若x=0,y=0则z=_______。温度、压强恒定时:若x=0,y=0则z_______。
(2)温度、体积恒定时:若x=0.75mol,y_______,z_______。温度、压强恒定时:若x=0.75mol,y_______,z_______。
(3)温度、压强恒定时:x,y,z应满足的关系是__________。
在673K,1.01×105帕下,有1mol某气体A,发生如下反应:2A(气) 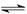 xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
“碘钟”实验中,3I-+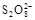 =I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(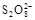 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s~44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号