[北京]2010届北京市海淀区中考一模化学试卷
为了防止废弃塑料带来的“白色污染”,下列做法不可取的是
| A.回收各种废弃塑料 | B.将用过的塑料袋立即焚烧 |
| C.使用可降解塑料 | D.用布购物袋替代一次性塑料购物袋 |
下面关于O2和CO2的叙述中,主要涉及物理性质的是
| A.O2能为可燃物助燃 | B.O2能供给呼吸 |
| C.干冰能用于人工降雨 | D.光合作用中CO2作原料 |
下列各组物质的俗名和化学名称均可表示同一种物质的是
| A.生石灰——氢氧化钙 | B.酒精——乙醇 |
| C.火碱——碳酸氢钠 | D.食盐——氯化钾 |
关于物质的用途,下列说法不正确的是
| A.合成纤维能用于制作服装 |
| B.铝合金能用于制造门窗框架 |
| C.合成橡胶能用于制造汽车轮胎 |
| D.葡萄糖能提供人体生命活动所需的全部能量 |
锌与盐酸发生的反应为:Zn + 2HCl = ZnCl2 + H2↑,此反应属于
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
根据右图提供的信息,下列说法不正确的是
| A.氯原子核外有三个电子层 | B.氯原子的最外层电子数为7 |
| C.氯原子的核电荷数为17 | D.氯原子在化学反应中失电子 |
下列有关木炭、硫、铁丝在氧气中燃烧时产生的共同现象是
| A.都产生浓厚的白烟 | B.都能放出热量 |
| C.都有气体生成 | D.都有蓝色火焰产生 |
下列化学用语的含义表达不正确的是
| A.2N:表示两个氮原子 | B.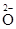 :表示负二价的氧元素: :表示负二价的氧元素: |
| C.3CO2:表示三个二氧化碳分子 | D.H2:表示一个氢分子由两个氢原子构成 |
下列说法正确的是
| A.镁条的质量等于它燃烧后生成物的质量 |
| B.蜡烛燃烧时逐渐变短,不符合质量守恒定律 |
| C.高锰酸钾受热分解的总质量等于生成物的总质量 |
| D.12 g碳和16 g氧气反应,可生成28 g二氧化碳 |
在实验室中为了鉴别氢氧化钠溶液和醋酸溶液,同学们提出了下列几种方法:①分别滴加紫色石蕊溶液 ②分别滴加酚酞溶液 ③闻气味 ④品尝 ⑤分别加入一小段镁带⑥分别加入大理石。其中可行的是:
| A.都可以 | B.①②③④ | C.①②③⑤⑥ | D.①③④⑤⑥ |
下列判断不正确的是
| A.某固体化肥与熟石灰混合研磨产生氨味,证明该化肥一定是铵态氮肥 |
| B.某物质燃烧产物只有二氧化碳和水,但该物质不一定只由碳和氢两种元素组成 |
| C.向某固体中滴加稀盐酸,产生的气体使澄清的石灰水变浑浊,但该固体不一定是碳酸钠 |
| D.某物质能与水反应,将少量该物质加到饱和石灰水中,溶液变浑浊,则该物质一定是二氧化碳 |
某同学对下列四个实验都设计了两种方案,其中方案1合理、方案2不合理的是
| 选项 |
A |
B |
C |
D |
| 实验 目的 |
清洗铁制品表面的铁锈 |
检验氢氧化钠溶液是否变质 |
除去二氧化碳中含有的少量一氧化碳 |
鉴别氢氧化钠和氯化钠固体 |
| 方案1 |
用适量稀盐酸洗 |
滴加稀盐酸 |
点燃 |
加水溶解,滴加酚酞溶液 |
| 方案2 |
用适量稀硫酸酸洗 |
滴加酚酞溶液 |
将气体通入澄清石灰水 |
加水溶解,测溶液温度 |
甲、乙、丙、丁四种物质有如右图所示的转化关系(部分反应物和产物已略去),则甲、乙、丙、丁依次是
A.C、CO、CO2、H2CO3
B.CO、CO2、C、H2CO3
C.CaO、Ca(OH)2、CaCl2、CaCO3
D.CaCO3、Ca(OH)2、CaCl2、CaO
甲、乙两种固体的溶解度曲线如右图所示。下列说法中,不正确的是
| A.M点表示在20℃时,甲、乙的溶解度相同 |
| B.20℃时,分别在50 g水中加入50 g甲、乙,加热到40℃时,二者均为饱和溶液 |
| C.40℃时,分别在100 g水中加入50 g甲、乙,所得溶液中溶质的质量分数:甲大于乙 |
| D.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,析出固体的质量:甲大于乙 |
某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26% 。取一份含有融雪剂的雪样充分溶于水后过滤,得到200 g 滤液和 2 g 杂质。取10 g滤液进行测定,假设溶液中氯元素、钙元素、钠元素均来自于融雪剂,且杂质中不含可溶物,其中含钙元素的质量为0.12 g。则所取样品中含有氯元素的质量为
| A.5.68 g | B.2.84 g | C.14.2 g | D.0.71 g |
化学与生活密切相关。
(1)识别织物成分常用灼烧法。若灼烧时,闻到了 ,则该织物中含有羊毛。
(2)“钙强化营养盐”的配料表:氯化钠、活性钙、碘酸钾。该盐中的营养成分表如下:
| 项目 |
能量 |
蛋白质 |
脂肪 |
糖类 |
钠 |
钙 |
碘 |
| 每100克 |
0 kJ |
0 g |
0 g |
0 g |
35385 mg |
250 mg |
2 mg |
①从上表中可知,此盐中含有___________种营养素。
②食用这种盐对人体健康有利的是___________(填序号)。
A.防止引起贫血病 B.维持人体内的水分和维持体液恒定的pH
C.防止甲状腺肿大 D.有助于骨骼和牙齿更坚固
③食品安全日益受到人们关注。下列食品因有毒而不能食用的是_________(填序号)。
A.甲醛浸泡的海产品 B.霉变的大米、花生
C.用亚硝酸钠(NaNO2)代替食盐烹调的食品 D.食盐腌制的咸鸭蛋
(3)正常的雨水因溶解了二氧化碳而显酸性,酸雨是指__________的雨水。
A. pH > 7 B. pH < 7 C. 5.6< pH < 7 D. pH < 5.6
(4)“节能减排”的环保理念贯穿了2010年上海世博会的全过程。下列措施不利于实现“节能减排”的是____________
A.开发使用太阳能 B.使用氢能燃料车
C.收集雨水用于绿化灌溉 D.直接将污水排入黄浦江
物质都是由粒子构成的,化学反应的实质是粒子之间的重新组合。
(1)右图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图,其中 和
和 分别表示氢原子和氮原子,则可知:
分别表示氢原子和氮原子,则可知:
①一个丙分子由 个原子构成。
②构成甲物质的粒子是 (填“分子”、“原子”或“离子”)。
③此反应中甲、乙、丙三种物质的粒子个数比为 。
(2)把一定质量的纯净物A和80 g B在一定条件下按下图所示充分反应,当B消耗完时,可生成88 g D物质和18 g E物质。
请回答下列问题:
①参加反应的A物质的质量是 。
②A分子中各元素的原子个数比是(需表示出元素种类) 。
金属的应用非常广泛。
(1)生活中常用铁锅炒菜,主要利用了铁的性质是(填序号) 。
A.导热性 B.导电性 C.延展性 D.有金属光泽
(2)下列能与铁发生反应的是(填序号) 。
A.氧气 B.稀盐酸 C.硫酸铜溶液 D.氯化锌溶液
(3)工业上,常在高温下用一氧化碳把铁从铁矿石中还原出来。若用磁铁矿(主要成分为四氧化三铁)冶炼铁,写出发生反应的化学方程式 。一些铁制品容易生锈。铁制品生锈的条件是 。
(4)某同学在探究金属活动性时做了下列实验:将一条铝片伸入盛有硫酸铜溶液的试管中,开始时没有明显现象,一段时间后,铝片的表面有气泡出现,且有红色固体生成。为了解释此“反常”现象,他查阅资料得知:配制硫酸铜溶液时常加入少量稀硫酸。上述实验中共发生了 个反应,其中产生红色固体物质的化学反应方程式是 。
(5)若向铜和稀硫酸的混合物中滴加过氧化氢溶液,只观察到溶液颜色变蓝,发生反应的化学方程式为 。
下图是有关稀盐酸和氢氧化钠溶液发生化学反应的微观示意图。请回答下列问题:
(1)A中溶液能使紫色石蕊溶液显 色,因为其中含有较多的(填粒子符号)_______;B中溶液能使无色酚酞溶液显 色,因为其中含有较多的(填粒子符号)________。
(2)将50 g 7.3% 的A中的溶液与50 g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号)________;C中的溶液中溶质的质量分数是______ 。
甲是初中化学中的常见物质,请根据下列叙述回答问题。
(1)若甲在常温下是液态,可以做一些溶液的溶剂,其75%的溶液常作为医用消毒。则甲的化学式为 ,
它属于(填序号) 。
A.有机物 B.纯净物 C.混合物 D.化合物 E.氧化物
(2)若甲是发酵粉的成分之一,在医疗上是治疗胃酸过多症的一种药剂。则甲的俗名是 ;甲与盐酸反应的化学方程式为 。
(3)若甲的固体可做气体干燥剂,但不能用于干燥CO2气体,那么甲溶液的pH 7(填“<”或“>” 或“=”),CO2气体不能被甲干燥的原因可能是 。
(4)若甲物质长期敞口放置会变质,则下列说法正确的是(填序号) 。
A.甲一定是氢氧化钠 B.变质的原因一定是与氧气发生了反应
C.变质后质量一定增加 D.变质一定是由化学反应引起的
现有下列实验装置示意图:
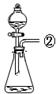
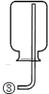

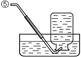
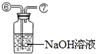
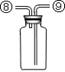
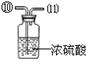
A B C D E F G H
请回答下列问题:
(1)A装置中a仪器的名称是 。
(2)选用A装置可以制备的一种气体是 ,制取该气体的化学反应方程式是 ,收集该气体可选用的装置为(请填序号,答出一种即可) 。
(3)现有如下资料:
① 制取NO2的反应原理:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑ +2H2O
② 通常状况下,NO2是一种密度比空气大的有毒气体,能与水发生反应。
③ NO2能与碱溶液反应生成盐和水。
若在实验室中用上述装置制备并收集一瓶干燥的二氧化氮气体,则所选装置从左到右的连接顺序为(填接口序号) 。
某兴趣小组做了如下实验。
【实验一】提纯NaCl
请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) 。
(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) 。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.蒸发时,看到晶体析出,立即停止加热
D.溶解11 g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制5%的氯化钠溶液50 g,不需要的仪器为(填序号) 。
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
【实验二】溶解和结晶KNO3
请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
| 实验操作 |
实验结果 |
| 取20 mL水,加入5 g KNO3,搅拌,恢复至20℃ |
全部溶解,得溶液① |
| 再加X g KNO3,搅拌 |
恰好饱和,得溶液② |
| 再加5 g KNO3,搅拌 |
得溶液 ③ |
| 加热 |
全部溶解,得溶液④ |
| 冷却至20℃ |
晶体析出,母液⑤ |
(4)③中溶液的质量为 ;一定属于不饱和溶液的是(填数字序号) ;溶质的质量分数一定相等的是(填序号) 。
(5)析出晶体的质量为(填序号) 。
A.5 g B.X+5 g C.X+10 g
某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。
该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。
工业上可用电解饱和食盐水的方法制备氢氧化钠,反应原理是:
2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑
2NaOH + Cl2↑+ H2↑
若电解含氯化钠23.4 t的饱和食盐水,则可制得氢氧化钠多少吨?(写出计算过程)


 粤公网安备 44130202000953号
粤公网安备 44130202000953号