[河南]2013届河南省信阳高中高三第三次大考化学试卷
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:①蛋白质的变性②蛋白质的盐析③胶体的聚沉④盐类水解⑤焰色反应⑥氧化还原反应
| A.①②③④ | B.①③④⑥ | C.②③④⑤ | D.②③⑤⑥ |
下列叙述正确的是
| A.发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B.金属阳离子被还原后,一定得到该元素的单质 |
| C.核外电子总数相同的原子,一定是同种元素的原子 |
| D.能与酸反应的氧化物,一定是碱性氧化物 |
下列结合实验现象的反应方程式正确的是()
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
| B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2 +2CO2=2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列两种气体的分子数一定相等的是
| A.质量相等、密度不等的N2和C2H4 | B.等温等密度的CO和C2H4 |
| C.等温等体积的 O2和N2 | D.等压等体积的N2和CO2 |
烧杯中盛有液态物质A,加入少量固体物质B,B不溶解。当通入气体C时发现B逐渐溶解直至完全溶解。则A、B、C依次为
A.H2O、BaSO4、O2 B.FeCl2溶液、Fe粉、Cl2
C.H2O、CaCO3、SO3气体 D.H2O、SiO2、HCl气体
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B.标准状况下,22.4L SO3的分子数为NA |
| C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA |
| D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
在下列给定的溶液中一定能大量共存的离子组是
| A.Kw/c(H+)=0.lmol/L的溶液中:K+、Fe2+、Cl—、NO3— |
| B.水电离的H+浓度为1×10-12 mol/L的溶液:K+、Ba2+、Cl—、Br— |
| C.加入NH4HCO3固体产生气泡的溶液中:Na+、Mg2+、ClO—、S2- |
| D.加金属铝能产生氢气的溶液中:Ca2+、NH+4、Cl—、HSO—3 |
下列叙述正确的是
| A.向含有 CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2 |
| C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D.向Na2CO3饱和溶液中通入CO2有NaHCO3结晶析出 |
在一密闭气缸内,用不漏气的可滑动的活塞隔成两室,左边充有氮气,右边充有氢气和氧气的混合气体,如下图所示。在室温下,将右边的混合气体点燃,反应后冷却到室温,活塞最终静止在气缸的中点。则原混合气体中氢气与氧气的体积比可能是
| A.2: 7 | B.7:2 | C.5: 4 | D.8:1 |
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3 沉淀 ⑥加入过量烧碱溶液
| A.①⑥⑤③ | B.②③④③ | C.②③⑤③ | D.①③⑤③ |
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):
下列说法不正确的是
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是金属镁,则W可能是强氧化性的单质 |
| D.若W为氧气,则Z与水作用(或溶于水)可能生成一种强酸 |
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 | B.Cl2 + FeI2 = FeCl2 + I2 |
| C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O | D.2Fe3+ + 2I— = 2Fe2++ I2 |
下列有关溶液性质的叙述,正确的是
| A.室温时饱和的二氧化碳水溶液,冷却到10 ℃时会放出一些二氧化碳气体 |
| B.20 ℃,100 g水中可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
| C.强电解质在水中溶解度一定大于弱电解质 |
| D.相同温度下,把水面上的空气换成相同压力的纯氧,100 g水中溶入氧气的质量增加 |
在一定条件下,将钠与氧气反应的生成物 1.4 g溶于水,所得溶液恰好能被 40 mL浓度为1.0 mol/L的HCl溶液中和,则生成物的成分是
| A.Na2O | B.Na2O2 | C.Na2O和Na2O2 | D.Na2O2和NaO2 |
在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是
| A.最后得到的溶液中不含有Cu2+ | B.残余固体一定全部是铜 |
| C.最后得到的溶液中只含Cu2+ | D.残余固体可能为铁、铜混合物 |
某无色溶液含有①Na+、②Ba2+、③Cl—、④Br—、⑤SO2-3;⑥SO2-4离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下: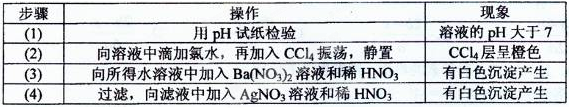
下列结论正确的是
| A.肯定含有的离子是①④⑤ |
| B.肯定没有的离子是②⑥ |
| C.不能确定的离子是① |
| D.不能确定的离子是③⑤ |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.7∶4 | B.7∶3 | C.7∶2 | D.7∶1 |
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体读数时仰视
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.①②⑤⑥ | B.①③⑤⑥ | C.②③④⑥ | D.③④⑤⑥ |
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。 请回答
请回答
下列问题:
(1)A物质的名称为_________,H与I反应的化学方程式
(2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是
___
(3)写出G→J的化学方程式:___ 、
(4)A→H的离子方程式为___________________________________________
(5)用离子方程式表示I物质能用于净水的原理_____________________ _
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用下图所示装置进行测定
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) 。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
已知A、B、C、D四种溶液分别为NaHCO3、Ca(OH)2、FeCl3、HCl,它们相互之间的反应现象如下表所示,其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示无现象。
(1)写出B的化学式 ,D的化学式 。
(2)写出B+C(过量)反应的离子方程式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号