[福建]2011-2012学年福建省漳州立人学校高二下学期期中考试化学试卷
下列表示方法中,错误的是 ( )
| A.1mol氮 | B.1molO | C.1molNa+ | D.1molH2CO3 |
 是重要的核工业原料,在自然界的丰度很低。
是重要的核工业原料,在自然界的丰度很低。 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关 说法正确的是( )
说法正确的是( )
A. 原子核中含有92个中子 原子核中含有92个中子 |
B. 原子核中有143个电子 原子核中有143个电子 |
C. 与 与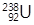 互为同位素 互为同位素 |
D. 与 与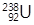 互为同素异形体 互为同素异形体 |
四种基本反应类型与氧化还原反应、非氧化还原反应的关系图正确的是( )。
A. |
B. |
C. |
D. |
下列化合物,按其晶体的熔点由高到低排列正确的是 ( )
| A.SiO2CaONaCl CBr4 CF4 |
| B.SiO2NaCl CaO CF4 CBr4 |
| C.CaONaCl SiO2 CBr4 CF4 |
| D.CF4CBr4NaCl CaO SiO2 |
下列说法正确的是( )
| A.同周期相邻主族原子序数一定相差一 |
| B.生石灰与水混合的过程只发生物理变化 |
| C.O3是由3个氧原子构成的化合物 |
| D.可用丁达尔效应区分溶液与胶体 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.标况下,11.2L的SO3含有1.5NA个氧原子 |
| B.NA个CO2的质量为44g•mol-1 |
| C.0.5mol·L-1CuCl2溶液中含Cl-数为NA |
| D.1L1 mol·L-1 Na2CO3溶液中所含阴离子数目一定大于NA |
按Si、P、S、Cl的顺序递增排列的是( )
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列物质的性质与氢键无关的是( )
| A.NH3分子比PH3分子稳定 | B.通常情况NH3极易溶于水 |
| C.冰的密度比液态水的密度小 | D.在相同条件下,H2O的沸点比H2S的沸点高 |
下列晶体熔化时不需要破坏化学键的是( )
| A.晶体硅 | B.食盐 | C.金属钾 | D.干冰 |
下列叙述中正确的是 ( )
| A.NH3、CO、CO2都是极性分子 |
| B.CH4、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、HI的稳定性依次增强 |
| D.CS2、H2O、C2H2都是直线型分子 |
已知I-、Fe2+、SO2和H2O2均具有还原性,它们在酸性溶液中还原性强弱的顺序为H2O2< Fe2+<I-<SO2,则下列反应不能发生的是 ( )
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+H2SO4=SO2↑+O2↑+2H2O | D.2Fe3++2I- =2Fe2++I2 |
76.8g铜与适量的浓HNO3混合,充分反应后固体物质完全消失,共收集到44.8 L(标准状况) NO2和NO的混合气体,则反应生成NO2和NO的物质的量之比是( )(不考虑NO2与N2O4的转化)
| A.1∶3 | B.1∶1 | C.9∶1 | D.3∶1 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
| |
|
||||
| |
|
X |
Y |
|
|
| Z |
|
|
W |
Q |
|
A.Z的最高化合价与X的最高化合价之和等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z 3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
下列关于物质分类的正确组合是 ( )
| |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
Na2CO3 |
H2SO4 |
NaHCO3 |
SiO2 |
CO2 |
| B |
NaOH |
HCl |
NaCl |
Na2O |
CO |
| C |
NaOH |
CH3COOH |
CaF2 |
SO3 |
SO2 |
| D |
KOH |
HNO3 |
CaCO3 |
CaO |
SO3 |
有一真空储气瓶净重500g,在相同条件下,装满CO2 后重511g,装满另一种X气体后重507g,则X可能是下列哪种气体( )。
| A.O2 | B.N2 | C.Cl2 | D.CH4 |
16用20mL0.1mol/L的FeSO4溶液,恰好还原1.0×10-3mol RO3- 离子,则R元素的最终价态为( )
根据下图所示的装置进行相关实验,对实验现象预测正确的是( )
| A.实验I:振荡后静置,上层溶液颜色保持不变 |
| B.实验II:酸性KMnO4溶液中出现气泡,且颜色不会褪去 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验IV:溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2= +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)
(1)方框中的物质应为_________
(2)若有1 molSO2 生成,则反应中电子转移数目为____ _____
(3)SO2是 产物。
将质量分数为98%,密度为1.84 g·cm-3的浓硫酸,用蒸馏水稀释到9.2 mol/L的硫酸,则其质量分数 49%(填>、<、=)。
(16分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。A、C两元素可形成非极性分子AC2。E、F两元素同周期、同族,且原子序数相差2。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。
(3)写出化合物AC2的结构式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E原子的核外电子排布式是 ,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
(6)若A与B两元素组成的晶体M,已知M具有与A元素形成的晶体相似的空间网状结构,请你判断晶体M与A元素的晶体硬度大小关系是:M A晶体(填>、<、=),并说明理由:_________________ _______________。
(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 mol σ键和 mol π键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)。
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
用Na2CO3·10H2O晶体,配制0.2 mol/L的Na2CO3溶液480 mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_____________,____________;
(2)应用托盘天平称取Na2CO3·10H2O的晶体的质量为_________________g;
(3)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容
正确的操作顺序是__________________(填序号)。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有____________,无影响的有________。(填序号)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号