[重庆]2012届重庆市万州区岩口复兴学校九年级下学期第一次月考化学试卷
下列有关金属的说法中正确的是
| A.常温下金属都是固体 |
| B.生铁和钢都是铁的合金,其中生铁的含碳量大于钢 |
| C.金属都是以化合物形式存在于自然界中 |
| D.铝在常温下就能与氧气反应,所以铝制品很容易锈蚀 |
一定量生铁中加入足量的稀硫酸,充分反应后,烧杯里留有少量黑色物质,其主要成分为
| A.碳 | B.四氧化三铁 | C.氧化铁 | D.铁粉 |
下列物质①FeCl3②ZnCl2③CuCl2④AlCl3,能用金属和盐酸直接反应制得的是
| A.①② | B.③④ | C.②④ | D.①③ |
现有a、b、c三种金属,将a、b分别放入稀硫酸、c的硝酸盐溶液中,现象如下表所示:
| |
a |
b |
| 在稀硫酸中 |
无反应 |
溶解并放出气体 |
| 在c的硝酸盐溶液中 |
无反应 |
无反应 |
则这三种金属的活动性由强到弱的顺序为
A. a、b、c B. b、a、c C. a、c、b D. c、b、a
将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如图。关于甲、乙两金属判断合理的是
| A.锌、铁 | B.镁、铁 | C.铁、锌 | D.锌、镁 |
将厨房中的食盐、味精(谷氨酸的钠盐)、花生油、白醋四种物质,取少量分别放入适量水中充分搅拌,不能形成溶液的是
| A.味精 | B.食盐 | C.花生油 | D.白醋 |
在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发忽略不计),不可能出现的情况是
| A.溶液变浑浊 | B.溶液变为不饱和 | C.溶液质量变小 | D.溶质质量分数变小 |
下列关于溶液的说法,不正确的是
| A.冷却或加入硝酸钾固体都能使接近饱和的硝酸钾溶液达到饱和 |
| B.汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出 |
| C.氨水是氨气的水溶液,根据气体溶解度变化规律,贮存时要阴凉密封 |
| D.氯化钠在20℃时溶解度是36g,则100g的氯化钠溶液中含有氯化钠36g |
A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是
A.将t2℃ A、B、C三种物质的饱和溶液降温至t1℃时,溶质的质量分数都保持不变
B.t2℃,A、B两种溶液中溶质的质量分数相同
C.t2℃时A、B的溶解度相等
D.要从A溶液中得到晶体A,通常可采用冷却热饱和溶液(降温结晶)的方法
下表所列为一些食物的近似pH,对于胃酸过多的病人,空腹时最宜食用的食物是
| 玉米粥 |
苹果 |
牛奶 |
柑桔 |
| 6.8~8.0 |
2.9~3.3 |
6.3~6.6 |
3.0~4.0 |
A. 玉米粥 B.苹果 C.牛奶 D. 柑桔
下列说法正确的是
| A.紫色的石蕊试液可使盐酸变红 |
| B.中和反应一定生成盐和水 |
| C.生成盐和水的反应一定是中和反应 |
| D.测定溶液的pH时,应先将pH试纸用蒸馏水润湿一下 |
某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是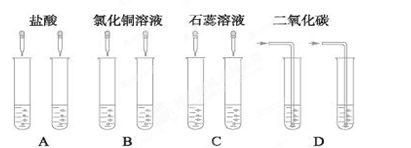
向盛有10mL氢氧化钠溶液的烧杯中逐滴滴加稀盐酸,下列图像能体现溶液的pH变化情况的是( ) 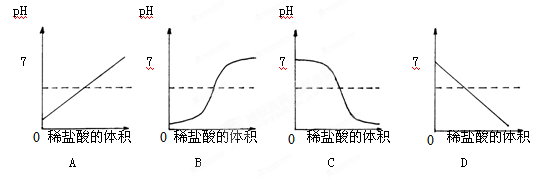
写出有关的的化学反应方程式:
(1)用稀硫酸除铁锈_________________________________;
(2)氢氧化钠溶液加入硫酸铜溶液中得到蓝色沉淀: ______________________________;
(3)用胃舒平(含氢氧化铝)治疗胃酸过多__________________________________________;
(4)用足量氢氧化钠吸收硫酸工厂的废气(SO2):___________________________________。
(6分)用H、O、Cl、Na元素组成物质按下列物质类别要求填空(填化学式):
①密度最小的单质 ②常温下是液态的非金属氧化物
③金属氧化物 ④无氧酸 ⑤碱 ⑥盐
建筑工地上,我们常看到刚买来的生石灰加水时热气腾腾,这是因为生石灰加水“煮”成了熟石灰的缘故,试回答:
(1)写出生石灰加水“煮”成了熟石灰的化学方程式: ,属于 反应(填反应类型)。
(2) 将生石灰加到足量的水中,充分“溶解”后,所得溶液中的溶质是 (填化学式,下同),溶剂是 。
向滴有酚酞的NaOH溶液中逐渐滴加稀盐酸,溶液由 色变为 色,化学方程式为 ,该反应除了属于基本反应类型 反应,还可以叫 反应。
下图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图③玻璃棒在此操作中的作用是 ;
(2)指出图 (填序号)中有一处错误操作;
(3)通过计算确定,需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水;
(4)用上述图示的序号表示配制溶液的操作顺序 ;
(5)小华在量取水时,仰视量筒读数,配出的氯化钠溶液质量分数 5%(填>,<或=)。
某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三某班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)回忆常见金属活动顺序表,在下表空格中分别填入对应的元素符号。
(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:
①操作a的名称是: ,进行操作a使用玻璃棒的作用是 。
②金属X是 (填化学式,下同),有关反应的化学方程式为 。
溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号