[江苏]2012届江苏省宝应县九年级网上阅卷适应性测试化学试卷
日常生活中常常见到下列现象,其中发生了化学变化的是
| A.冬天的早晨,玻璃窗上出现美丽的雪花 | B.自行车轮胎在烈日下爆裂 |
| C.牛奶放置时间过长结块 | D.玻璃杯打碎 |
PM2.5是指大气中直径小于或等于2.5微米的颗粒物.2.5微米以下的细颗粒物主要来自化石燃料的燃烧等.以下不属于化石燃料的是
| A.天然气 | B.石油 | C.煤 | D.氢气 |
在太空舱里,为了保持舱内O2、CO2气体含量的相对稳定,常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2。NiFe2O4中铁为+3价,则Ni的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
“齐二药”假药事件是将“二甘醇”用于药品生产造成的。“二甘醇”在人体内可发生如下反应:C4H10O3+4O2=2X+3H2O,而导致人中毒。X的化学式为
| A.C4H4O8 | B.C2H4O4 | C.C2H2O2 | D.C2H2O4 |
下列固体溶于水后,溶液温度升高的是
①氢氧化钠 ②氯化钠 ③硝酸铵 ④生石灰
| A.①②③ | B.①②③④ | C.①② | D.①④ |
有关硬水和软水的说法不正确的是
| A.硬水洗涤衣物不容易洗净 | B.硬水通过蒸馏可以得到软水 |
| C.硬水烧开后有白色沉淀产生 | D.硬水通过过滤就可以得到软水 |
用分子的观点解释下列现象,不合理的是
| A.食物变质——分子本身发生了变化 | B.汽油挥发——分子大小发生了变化 |
| C.热胀冷缩——分子间间隔改变 | D.花香四溢——分子作扩散运动 |
如下图实验,放置1—2周时间后,装置中能出现的现象是
| A.铁丝不变化 | B.试管中的液面不变化 |
| C.铁丝逐渐消失 | D.试管中的液面上升 |
下表是某酸碱指示剂在不同的pH范围内显示的颜色:
| 颜色 |
红 |
橙 |
绿 |
蓝 |
紫 |
| pH 范围 |
1~3 |
4~5 |
6~7 |
8~10 |
11~14 |
向滴有少量该指示剂的稀盐酸中,逐滴加入氢氧化钠溶液,出现的颜色变化是
A.由紫色到红色 B.由无色到蓝色 C.由蓝色到绿色 D.由红色到蓝色
某高层住宅发生重大火灾。下列逃生措施①沿楼梯迅速上移②用湿毛巾堵住口鼻③匍匐前进,寻找安全出口④封闭房门⑤迅速转移到阳台等待救援⑥跳楼,其中正确的选项是
| A.②③④⑤ | B.①②③④ | C.③④⑤⑥ | D.①②④⑤ |
丁烷(化学式为C4H10)可作为火炬燃料,它燃烧时火苗明亮。下列关于丁烷的叙述中正确的是
| A.丁烷由碳、氢两种元素组成 | B.丁烷中碳、氢元素的质量比为2∶5 |
| C.丁烷的相对分子质量58g | D.丁烷由4个碳原子和10个氢原子构成 |
在点燃条件下,A和B反应生成C和D,反应前后分子种类变化的微观示意图如下,下列说法错误的是
| A.B是O2 | B.A中氮呈-3 |
| C.该反应的基本类型是置换反应 | D.在该反应中,生成C和D的质量比为14:9 |
双球洗气管可用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。如图是用水吸收下列某气体时的情形,
根据表中提供的数据判断,最容易被水吸收的气体是( )
| 四种气体的溶解情况表(20℃、101kPa) |
||||
| 气 体 |
Cl2 |
HCl |
H2S |
CO2 |
| 1体积水约能吸收气体体积数 |
2 |
500 |
2.6 |
1 |
A.Cl2 B.HCl C.H2S D.CO2
A、B、C、D是初中化学中常见的物质,A与B作用,生成C和D,反应关系如下图所示。其中常温下B为固体,C为气体,部分生成物可能省去。则下列推断结果符合要求的是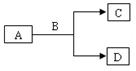
A.A为稀HCl,B为CuO B.B为CaCO3,C为CO2
C.A为H2O2溶液,D为H2O D.A为Zn,B为稀H2SO4
下表是小明同学在除杂时所选用的试剂,其中正确的是
| 选项 |
物质 |
杂质 |
试剂 |
| A |
K2SO4溶液 |
(NH4)2SO4 |
KOH溶液 |
| B |
CaO固体 |
CaCO3 |
稀HCl |
| C |
CO2气体 |
HCl |
NaOH溶液 |
| D |
FeSO4溶液 |
CuSO4 |
Fe粉 |
如图是 A、B、C三种固体物质(均不含结晶水)的溶解度曲线,根据图示,下列说法不正确的是( )
A.t1℃时,取50gA的饱和溶液,将温度升高到t2℃,此时溶液中A的质量分数变大(假设升温时溶剂没有损失)
B.t1℃,将A、B、C各ag放入100g水中,充分搅拌,所得溶液溶质质量分数均相等
C.t3℃时,取相同质量的A、B、C三种饱和溶液降温到t1℃,析出晶体最多的是A,没有晶体析出并变成不饱和溶液的是C
D.从A与少量C的混合物中提纯A,可用蒸发结晶的方法
含钠2.3%的100gNaCl、NaOH、Na2CO3的混合溶液与足量稀HCl充分反应后,再蒸发,所得固体的质量为( )
| A.2.3g | B.5.85g | C.11.7g | D.23g |
按要求写出化学符号:
(1)2个N原子 ; (2)2个氨分子 ;
(3)3个硫酸根离子 ; (4)氧化锌中锌元素呈正二价 ;
(5)5%葡萄糖注射液的溶质 ;(6)碘元素 。
选择适当物质的序号填空。
| A.二氧化碳 | B.明矾 | C.硝酸钾 | D.氮气 E.石灰石 F.聚乙烯 |
(1)可用于人工降雨的是 ; (2)农业上可作复合肥的是 ;
(3)可用于净水的是 ; (4)生常用于保护蔬菜瓜果的气体是 ;
(5)用于作食包装材料的 __; (6)可用作建筑材料的是____。
生活中的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
| 合金 |
合金的主要性能 |
主要成分及纯金属的性能 |
| 焊锡 |
熔点183℃ |
锡:熔点232℃;铅:熔点327℃ |
| 硬铝 |
硬度好 |
铝、铜、镁等,硬度小 |
| 不锈钢 |
抗腐蚀性好 |
铁、碳、铬、镍等,纯铁抗腐蚀性不如不锈钢。 |
(1)由上表可以推断,与组成合金的纯金属相比、合金的优点一般有 、 ;
(2)把硬铝放在足量的盐酸中,最后剩余的金属是 ,写出发生反应的其中一个化学方程式 ;该反应的基本类型属于 反应。
(3)铁制品暴露在空气中会发生锈蚀,而在铁中熔合了一定量的碳、铬、镍等形成不锈钢后,改变了纯铁的 ,因而其抗锈蚀性能比纯铁好得多。
右图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
| 纯牛奶 保持期:8个月 净含量:250mL/盒 营养成分:(每100mL) 钙≥0.1lg 脂肪≥3.3g 蛋白质≥2.9g |
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中至少含有3.3g的脂肪。那么一盒牛奶中至少含有 g 脂肪(保留到0.01g)。
(2)人体中的钙主要以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在。羟基磷酸钙的相对分子质量为 ;羟基磷酸钙中钙元素的质量分数是 (保留到0.1%)。
(3)人体中含量最高的金属元素 (填“是”或“不是”)钙。
(4)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝 盒牛奶,书写另一可用于补钙的食物 。
下图是工业生产纯碱的工艺流程示意图。
已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
(1)粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为 ,书写其中一个反应的化学方程式 ;
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 ,“碳酸化”时,NaCl、NH3、CO2和H2O相互作用析出NaHCO3,写出该反应的化学方程式 。
(3)“碳酸化”后过滤获得的NH4Cl可用作 肥,也可先 (填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是 ;
(4)“煅烧”时,NaHCO3分解生成的气体D是 ,若将气体D直接排入空气不合理的理由是 。
(5)鉴别产品纯碱中是否含有碳酸氢钠的方法是 。
下图所示为实验室常用的实验装置。
据此回答下列问题:
⑴写出带标号仪器的名称:① ② ;
⑵实验室通常用稀盐酸和石灰石反应制取CO2,该反应的化学方程式为 ,发生装置为 ;装置F可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是,植物油上方原有的空气对实验的结果 (填“有”或“没有”)明显影响。
⑶小丫在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入一定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
【讨论】小丫认为易拉罐变瘪,说明CO2与NaOH溶液发生反应;小敏认为此结论不合理,还需进一步验证,验证方法是 ;易拉罐为什么又后鼓起来?是不是反应又产生了气体,该气体的成分?
【提出猜想】a.可能是CO2 b.可能是 。
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝不仅与酸反应,还能与碱溶液反应2Al+2NaOH+2H2O==2NaAlO2+3X↑
【实验验证】
①将易拉罐口打开,迅速用燃着的木条伸入罐口,发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭。证明猜想 成立;
②取少量铝片于试管中,先加入适量的水,无明显变化。片刻后再加入少量的氢氧化钠浓溶液,产生气泡。该步实验的目的是 ;
【结论】CO2与NaOH反应的化学方程式是 ;
【反思与应用】在生活中铝制容器不能用来盛装酸性物质,也不能盛装 性物质。
某学习小组用如图所示装置测定锌铜合金中铜的质量分数。(已知:金属与酸时放出一定的热量)
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是 ;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③由A向B滴加足量试剂;④检查气密性。
上述再进行的操作的顺序是 (填序号);
(3)该装置的气密性的检验方法是打开分液漏斗旋塞,从D管注入经济易得的 ,使U型管左右液面相平,关闭分液漏斗旋塞,提高D管,,说明装置的气密性好;
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和 ;
(5)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为V L,为求出合金中铜的质量分数,还缺少的一个数据是 ;
| A.反应前加入稀硫酸的体积 | B.反应前加入稀硫酸的质量分数 |
| C.实验前反应装置中空气的体积 | D.实验条件下氢气的密度 |
(6)若a为0.4g,V为80mL,求合金中铜的质量分数。(在实验条件下,H2的密度为0.09g/L,5分)
(7)实验过程中,若未冷却就读取气体体积,则测得锌的质量分数将 (填 “偏大”、“偏小”或“不受影响”)。
(8)可指导老师认为,利用上述实验装置,测量结果总会偏小,原因是,改进方法是 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号