[江苏]2012届江苏省江都市中考二模化学试卷
人类生活需要能量。下列能量主要由化学变化产生的是( )
| A.风力发电站产生的电能 | B.太阳能热水器 |
| C.核电站产生的电能 | D.天然气燃烧放出的热量 |
下列实验操作不正确的是 ( )
| A.将食盐放在托盘天平左盘的纸上称量 |
| B.将试管夹从试管底部往上套,夹在试管的中上部 |
| C.天平不调节平衡直接称量 |
| D.滴加液体时,滴瓶滴管的尖端不能触及已加过其它试剂的试管内壁 |
下列几种溶液敞口久置于空气中,溶液的质量增加且溶质质量分数减小的是( )
| A.浓盐酸 | B.浓硝酸 | C.浓硫酸 | D.石灰水 |
打火机的主要燃料是丁烷(C4H10),下列有关说法不正确的是 ( )
| A.丁烷由丁烷分子构成 | B.丁烷完全燃烧只生成水 |
| C.丁烷由碳、氢两种元素组成 | D.丁烷分子是由碳原子和氢原子构成 |
某建筑工地发生多人食物中毒,经化验为误食工业用盐亚硝酸钠(NaNOx)所致,NaNOx中氮元素的化合价是+3, 则x的值为 ( )
| A.1 | B.2 | C.3 | D.4 |
已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32。如果该氧原子的质量为m.则该硫原子的质量为 ( )
| A.32m | B.2m | C.m | D.不能确定 |
下列有关碳循环的说法错误的是 ( )
| A.绿色植物光合作用吸收CO2释放O2 |
| B.动、植物呼吸作用吸收O2释放CO2 |
| C.用石灰水吸收空气中过量的CO2,以解决温室效应 |
| D.提倡“低碳生活”,大力推广风能、太阳能等新能源 |
下列各组物质,均属于纯净物的是 ( )
| A.盐酸、牛奶、汽水 | B.生铁、黄铜、铁锈 |
| C.干冰、纯碱、胆矾 | D.医用酒精、生理盐水、纯净水 |
在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。已知钾与水反应生成对应的碱和一种气体,该气体可能是( )
| A.H2 | B.O2 | C.CO2 | D.NH3 |
下列叙述正确的是 ( )
| A.青少年的生长过程需要大量蛋白质,所以要多吃水果 |
| B.油脂和糖类物质都能够为人体提供热量 |
| C.合成纤维、合金、合成橡胶都是合成材料 |
| D.焚烧塑料是解决“白色污染”的好办法 |
下列图像能正确反映所对应叙述关系的是 ( )
| A.向pH=1的溶液中不断加水 | B.一定量的稀盐酸与镁粉反应 |
| C.向HCl和MgCl2混合液中滴加NaOH溶液 | D.加热木炭和氧化铜的混合物 |
下列除杂的实验过程都正确的是(括号内为杂质)( )
| A.KCl(K2CO3)加足量稀硫酸、过滤、蒸发、结晶 |
| B.BaSO4(BaCO3)加足量稀盐酸、过滤、洗涤、干燥 |
| C.CuO(Cu)加足量稀盐酸、过滤、洗涤、干燥 |
| D.MnO2 (KCl)加水溶解、过滤、蒸发、结晶 |
正常人胃液的pH在0.9~1.5之间,胃酸(一般以盐酸表示)过多,则需要治疗。一般可用含MgCO3或NaHCO3的药物治疗胃酸过多。这主要是由于 ( )
| A.碳酸镁、碳酸氢钠都属于盐 |
| B.碳酸镁、碳酸氢钠都属于碱 |
| C.Na+和Mg2+都是人体中的必需元素 |
| D.MgCO3、NaHCO3与胃酸作用生成易分解的弱酸碳酸 |
潜艇里常使用一种化合物,将CO2转化为O2同时生成Na2CO3,据此推断该化合物中一 定含有的元素是 ( )
A、一定含有Na、C、O B、一定含有Na、C
C、一定含有Na、O D、一定含有Na
由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为( )
| A.12% | B.24% | C.20% | D.30% |
下列说法错误的是 ( )
| A.化学反应是人类获取能量的重要方式 | B.过滤能使硬水变成软水 |
| C.催化剂在化学反应前后质量不发生改变 | D.铁在干燥的空气中容易生锈 |
下列各组固体物质,只用水不能进行鉴别的是( )
| A.K2SO4、KCl | B.CaCO3、Na2CO3 |
| C.CaO、Ca(OH)2 | D.CuSO4、Fe2(SO4)3 |
下图是甲、乙两种物质的溶解度曲线。在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响,且溶质仍是甲、乙),充分搅拌。将混合物的温度降低到t1℃。下列说法正确的是( )
| A.甲物质的溶解度随温度升高而减小 |
| B.温度降低到t1℃时,得到甲、乙的饱和溶液 |
| C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的不饱和溶液 |
| D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液 |
关于合金,下列说法错误的是( )
| A.合金是化合物 |
| B.合金的硬度一般比各成分金属大 |
| C.多数合金的熔点低于组成它的成分金属 |
| D.合金中至少含有两种金属 |
在化学反应aA+bB = mC+nD中,下列说法正确的是 ( )
| A.化学计量数a与b之和一定等于m与n之和 |
| B.若取ag A和ag B反应,生成C和D的质量总和不一定是2ag |
| C.反应物A和B的质量比一定等于生成物C和D的质量比 |
| D.若B和D都是盐,则该反应可能是复分解反应 |
(1)在①氧气、②金刚石、③氢气、④盐酸四种物质中,可用于除去铁锈的是(填序号,下同)______;可以供给呼吸的是_______;可作为新型气体燃料的是_______。
(2)地壳中含有大量的硅元素,它的含量仅次于 元素。高纯度的单质硅是计算
机的核心材料,工业上制取单质硅的第一步反应的化学方程式为:
SiO2+2C=Si+2R,其中R的化学式为 ;该反应属于基本反应类型中的
反应。
下图是某小组同学验证质量守恒定律实验的片段。
(1)如图甲所示,天平无法调节平衡。要使该天平平衡,应采取的措施 ;
(2)小明用图乙所示装置进行实验。反应前称得左盘内装置及物质总重量为 g,然后注入稀盐酸,充分反应后,能证明质量守恒定律的现象是 ;上述实验向氢氧化钠溶液中滴入酚酞的目的是 ,该反应的化学方程式为 ;
(3)小丽向氢氧化钠溶液中注入稀盐酸,发现有气泡产生,其原因是 。
中国2010上海世博会的主题是“城市,让生活更美好”。
(1)世博园内使用电动车,有效减少了CO2、SO2、CO的排放,这些物质会引起温室效是 ,会造成酸雨的是 , 。
(2)世博园内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭起 作
用;用紫外线代替氯气对水进行处理,其作用是 。
世博会上所使用的饭盒、胸卡、证件等都用可完全降解的“玉米塑料”制成,制作的
第一步是将玉米发酵制得乳酸(C3H6O3),乳酸由 种元素组成,其中碳元素的质量
分数为 。
人们可以对物质从不同的角度进行分类。请根据示例将酒精、醋酸、水、食盐四种物质进行分类,并写出分类依据。
| |
不同类的物质 |
分 类 依 据 |
| 示 例 |
食 盐 |
常温下食盐是固体,其余是液体 |
| 分类一 |
|
|
| 分类二 |
|
|
这学期,小亮和班级的两名同学主动承担了维护班级花坛的工作。前不久,他们发现有部分花的叶面出现了枯黄的现象,便及时向花坛里施用了足量的化肥,但效果并不明显。他们决定用所学的化学知识来解决这一问题。
(收集资料)
(1)花的叶色枯黄,他们选择施用_____________(填写“氮”、“磷”或“钾”)肥是正确的。
(2)前一段时间他们曾用熟石灰(化学式为_______________)对花坛中的___________性土壤进行过改良。
(3)近一个星期一直无雨,气温较高。
(4)通过查阅资料,小亮和同学们知道:含NH4+的盐受热或与碱混合会放出有刺激性气味的氨气,氨气的水溶液呈碱性。
(提出假设)
(1)太阳的曝晒和气温升高都可使肥效流失。
(2)熟石灰与化肥反应也可使肥效流失。
(设计并进行实验)
(1)小亮取少量这种化肥于试管中加热,并在试管口放一条干燥的pH试纸,pH试纸无变化。
(2)另取少量这种化肥与熟石灰混合,闻到____________气味。
[他的结论)由以上第二个实验中的现象他能得出肥效流失与_____________有关。
(反思与应用)
(1)小亮进行的第一个实验中,pH试纸无变化,这与查阅资料给出的信息不符,其原因是
。
(2)参与了小亮和同学们的探究活动,想必你也一定受到了启发,你能对小亮保存剩余化肥提出一条合理化建议吗?
、金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2;(过氧化钠还能与盐酸、水等物质发生反应产生氧气)为了验证该反应中氧气的产生,某兴趣小组的同学设计了如右图所示的实验。
(1)实验室确定气体发生装置时应考虑的因素是 ;
制取CO2的装置,应从下列图1、图2、图3中选择 。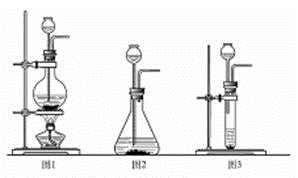
(2)检查图2装置的气密性的方法是:将装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到 现象,即可证明装置不漏气。
(3)设计A、B装置的目的是净化导入的纯净且干燥的CO2。其中,A装置的具体功能是________________所发生的化学方程式是 ;B装置的具体功能是 ,其瓶内液体应是___________ ;
(4)为了确定CO2跟Na2O2反应产生的气体是氧气,最后还要采用的验证实验操作是______。
(5)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(6)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
(7)某潜水艇上有4人,如果每人每小时消耗的氧气在某温度和压强条件下体积为50L,则该潜水艇中每天需要过氧化钠多少千克?(已知:在上述温度和压强条件下氧气的密度为1.5g/L) 。
某校研究性学习小组进行了一个有趣的实验探究:
《提出问题》实验室有一瓶久置的NaOH,变质程度怎样?
《设计方案》先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3
的质量,从而进一步确定样品中NaOH的质量分数。
《进行实验》实验测得加入稀盐酸的质量与产生CO2气体的质量关系如下图所示。
《数据处理》写出以下计算过程:
(1)该样品中Na2CO3的质量为多少?
(2)该样品中NaOH的质量分数为多少?
《反思与交流》①从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是 ;②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗强酸的量 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号