[湖北]2012届湖北省襄阳市高三3月调研考试理科综合试卷(化学部分)
依据元素周期表和元素周期律,下列推断正确的是
| A.Mg(OH)2的碱性比Be(OH)2的强 |
| B.HCl、HBr、HI的热稳定性依次增强 |
| C.H3BO3的酸性比H2CO3的强 |
| D.若M+ 和R2-的核外电子层结构相同,则原子序数:R > M |
某烃分子中碳、氢两种元素质量比为5 : 1,且分子中含有3个甲基,则该烃分子的一氯代物共有几种(不考虑空间异构)
| A.1 | B.2 | C.3 | D.4 |
下列关于有机物的说法正确的是
| A.乙烯与Br2发生加成反应生成CH3CHBr2 |
| B.酸性高锰酸钾溶液可确定苯和乙醇的混合液中混有乙醇 |
| C.葡萄糖、油脂、蛋白质都是可水解的高分子化合物 |
| D.乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 |
常温下,某未知溶液中 ,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是
,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
某新型碱性可充电电池,能长时间保持稳定的放电电压。该电池的总反应为3Zn+2K2FeO4,8H2O  3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是
| A.电池放电是化学能转化成电能的过程 |
| B.放电时正极反应为:FeO42-+ 4H2O + 3e-===Fe(OH)3 + 5OH- |
| C.充电时电池的负极接外电源的正极 |
| D.充电时电解质溶液中的阴离子向阳极定向移动 |
下列离子方程式书写正确的是
| A.用硫氰化钾检验某溶液中含有Fe3+: Fe3++ 3SCN-===Fe(SCN)3↓ |
| B.Cl2和水反应:Cl2 + H2O ="==" 2H++ Cl-+ ClO- |
| C.向酸性KMnO4溶液中加入适量NaNO2溶液,紫色褪去:2MnO4-+ 5NO2-+6H+===2Mn2++5NO3-+3H2O |
| D.铜与稀硝酸反应:Cu + 4H++ 2NO3-="==" Cu2++2NO2↑+2H2O |
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是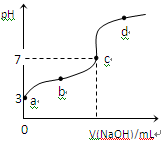
| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液c(CH3COO-) > c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中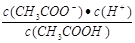 相等 相等 |
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和无色、有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱。E分子含18个电子,在足量空气中燃烧生成G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)组成单质A的元素位于周期表中第 周期第 族;
(2)化合物H的电子式为 ;
(3)B与氢氧化钠溶液反应的离子方程式为: ;
(4)G与氯酸钠溶液反应可生成消毒杀菌剂二氧化氯。写出对应的离子方程式:
(5)溶液F在空气中长期放置生成H的化学反应方程式为: ;
(6)写出F溶液中各离子浓度由大到小的关系为: ;
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2
FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| |
700℃ |
900℃ |
| K1 |
1.47 |
2.15 |
| K2 |
2.38 |
1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度 mol·L-1。
②下列措施中能使平衡时 增大的是 (填序号)
增大的是 (填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,
并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
(1)写出甲中反应的离子方程式 。
(2)为完成上述实验,正确的连接顺序为A连 ,B连 (填接口字母)。
(3)乙装置中X试剂可以是 ,丙装置中Y试剂的作用是 。
(4)测定Cu的相对原子质量。将w g CuO置于硬质玻璃管中,足量的H2与之充分反应后,按以下两个方案测得的数据计算Cu的相对原子质量。
| 方 案 质 量 |
方案一 |
方案二 |
| U型管+固体 |
硬质玻璃管+固体 |
|
| 反应前质量/g |
a |
c |
| 完全反应后质量/g |
b |
d |
你认为方案 较佳,另一个方案得到的Cu的相对原子质量会 (填“偏低”、“偏高”)。按较佳方案计算,得到Cu的相对原子质量是 。
【化学——选修2:化学与技术】
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生反应的化学方程式为 ;接触室中发生反应的化学方程式是 。
(2)沸腾炉出来的炉气需要精制,如果不经过精制,对SO2催化氧化的影响是
(3)硫酸工业是一种易造成多种形式污染的工业,工业上常采用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理: ;对矿渣的合理利用方法是 。
(4)某工厂用500t 含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是 t。
【化学——选修3:物质结构与性质】
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
【化学——选修5:有机化学基础】
已知某有机物A为烃类化合物,其相对分子质量为70,各物质之间的转化关系如下图所示,其中B、D、E的结构中均含有2个甲基,且核磁共振氢谱都有4个峰。
(1)A的分子式为 ,D中所含官能团的名称为 。
(2)I的反应条件为 ,Ⅲ的反应类型为 。
(3)写出反应Ⅳ中①的化学方程式 。
(4)写出反应Ⅴ的化学方程式 。
(5)E有多种同分异构体。其中:
①能发生银镜反应,又能与金属钠反应生成氢气,但不能发生消去反应: ;
②能在酸性条件下水解,且两种水解产物相对分子质量相同: 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号