[福建]2011年初中毕业升学考试(福建福州卷)化学
下列说法不符合"节能减排、低碳生活" 理念的是
 技术
技术
水是生命之源,下列有关水的说法错误的是
| A. | 水是一种重要的溶剂 |
| B. |
用肥皂水可以区分硬水和
 软水 软水
|
| C. | 生活中可以用煮沸的方法降低水的硬度 |
| D. | 通过过滤可以除去水中所有的杂质 |
三氧化二铋( )俗称铋黄,是制作防火纸的材料之一。三氧化二铋中铋元素的化合价是
| A. | B. | C. | D. |
压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体
| A. | 分子间隔增大 | B. | 分子个数增多 |
| C. | 分子质量增大 | D. | 分子体积增大 |
下列化学用语与含义不相符的是()
| A. | -氯化铝 | B. | 钙离子- |
| C. | 2个氧元素-2O | D. | 2个水分子- |
日常生活中部分常见物质的
如下图所示。据图判断,下列说法正确的是( )

| A. | 橙汁、酸奶都呈酸性 | B. | 小于7的雨水都属于酸雨 |
| C. | 肥皂的碱性比氨水强 | D. | 柠檬酸不能使紫色石蕊试液变红 |
根据图3的有关信息判断,下列说法错误的是

常见金属活动性顺序如图4:

下列各组物质间能发生反应的是()
| A. | 铜和硝酸钠溶液 | B. | 铁和稀盐酸 |
| C. | 锌和氯化钾溶液 | D. | 银和稀硫酸 |
下列有关尿素 的说法,错误的是
| A. | 它可以作氮肥 |
| B. | 尿素分子中碳、氢原子个数比为1:4 |
| C. | 尿素由碳、氧、氮、氢四种元素组成 |
| D. |
尿素中氮元素的质量分数

|
氯化铵和硝酸钾溶解度曲线如图5所示,下列叙述正确的是

| A. | 60℃时,硝酸钾的溶解度小于氯化铵的溶解度 |
| B. | 40℃的硝酸钾饱和溶液降低温度会变为不饱和溶液 |
| C. | ℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等 |
| D. | 60 ℃时,100 水中加入120 硝酸钾,充分搅拌,得到的是硝酸钾不饱和溶液 |
联合国第63届大会决定将2011年作为国际化学年(IYC2011),其主题是"化学--人类的生活,人类的未来"。请回答下列化学与人类生活相关的问题。




(1)下列服装主要用有机合成材料制成的是
A.羊毛衫 B.涤纶连衣裙 C.腈纶运动衣 D.纯棉T恤
(2)自热米饭是一中快餐食品。请根据图6、7及表1信息,回答下列问题:

①自热米饭的营养素中,主要负责提供能量的是
②图7中菜肴包的包装材料是符合卫生标准的铝箔。铝可以压制成铝箔,说明铝具有良好的
③该自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为
(3)良好的家居环境带来美好的生活。
①房屋装修后,可在室内放一些活性炭来吸收装修材料释放出的甲醛、苯等有毒气体,这是利用活性炭的
②图8所示的"火立熄"是一种新型的家用灭火用品。"火立熄"接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃烧气体,使火焰熄灭。"火立熄"的灭火原理是

A.清除可燃物
B.使燃烧物与氧气隔绝
C.降低燃烧物的着火点
(4)汽车是现代生活中常见的一种交通工具。
①喷漆可以延缓汽车钢铁外壳的锈蚀,起防锈原理是隔绝
②CNG双燃料环保汽车已在福州投入使用,这种汽车所用的燃料是汽油和压缩天然气。写出天然气完全燃烧的化学方程式:
A、B、C是三种不同类别的含有氧元素的化合物,物质间相互反应的关系如图9所示(图中"─"表示相连的两种物质能在溶液中发生反应)。若B为纯碱,
A、C间的反应为复分解反应,回答下列问题:
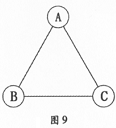
(1)物质A、B、C的化学式是
ABC。
(2)物质A和C在溶液中反应的化学方程式是。
(3)纯碱是一种用途是。
高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜粉氧化法获取高纯度氧化铜的流程图。

回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把
(2)写出硫酸与氧化铜反应的化学方程式:
(3)写出固体
所含的物质:
(4)洗涤固体
应使用的试剂是
根据所学知识并结合图11所示装置回答下列问题。

(1)图中标有①、②的仪器名称:① 、② 。
(2)用装置B制取一种气体的化学方程式为 。
(3)用高锰酸钾制取氧气的化学方程式为 ,若选择A和C装置制取并收集氧气,则要对A装置进行的改进是 ,证明氧气已收集满的方法是 。
(4)组装一套实验室制取并收集二氧化碳的装置,可选用图中 和 。(填标号)检验二氧化碳的方法是 。(用化学方程式表示)
某课外活动小组同学用图装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:

①取一段镁带样品,准确称得其质量为0.030
。
②往量气管内装水至低于刻度"0"的位置。按图12所示(未装药品)装配好仪器.
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96
。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式。
(2)能否用托盘天平称量0.030
镁带样品。(填"能"或"不能")
(3)若不改变温度,如何用较简单的方法检查图12所示装置的气密性?。
(4)经换算,该实验获得的氢气质量为0.0020
。该镁带中单质镁的质量分数是。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果(填"是"或"否")。理由是。




 总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食
总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食 醋样品中其它物质不与氢氧化钠发生反应)
醋样品中其它物质不与氢氧化钠发生反应) 粤公网安备 44130202000953号
粤公网安备 44130202000953号