[福建]2011年初中毕业升学考试(福建厦门卷)化学
下列实验事故处理正确的是()
| A. | 可燃性气体大量泄漏时,立即接通电源用排气扇排气 |
| B. | 酒精灯中的酒精洒在桌上燃烧起来,立即用湿抹布扑盖 |
| C. | 氢氧化钠溶液沾到皮肤上,直接涂上浓盐酸 |
| D. | 少量浓硫酸沾到皮肤上,用大量水冲洗,然后涂上浓氢氧化钠溶液 |
实验室配制
质量分数为
的氢氧化钠溶液,下列描述正确的是
某课外活动小组取刚降到地面的雨水水样,用
计(测
的仪器)每隔5
测一次该水样的
,数据如下表。已知酸雨的
,下列说法错误的是

| A. | 测定的时间内该水样的酸性减弱 |
| B. | 该雨水是酸雨 |
| C. | 该取样地点的空气可能受污染 |
| D. | 用 试纸不能测得表中数据 |
近期,英国科学家造出"干水"。"干水"的每个颗粒内部是一颗水滴,外层是二氧化硅。下列有关判断正确的是
氯化铵和硫酸钠溶解度曲线如下图所示,从图中获取信息正确的是

| A. | 20℃~40℃,氯化铵的溶解度大于硫酸钠 |
| B. | 两种物质溶解度都随温度升高而增大 |
| C. | 45℃时两种物质饱和溶液的溶质质量分数相等 |
| D. | 将50℃的硫酸钠饱和溶液降至20℃,始终没有晶体析出 |
如下图所示,将足量的某铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水
的烧杯中。实验过程中,观察到试管内液面缓慢上升。下列分析错误的是( )

| A. | 水能进入试管的最大体积约为试管容积的1/5 |
| B. | 该铁粉在试管内发生了氧化反应 |
| C. | 这一实验可以验证空气的组成不是单一的 |
| D. | 如把该铁粉改为木炭粉,两者的现象完全相同 |
往盛有稀硫酸的烧杯中加入足量的氧化铜粉末,充分反应后,再向烧杯中继续加
入某种金属。实验过程中,烧杯中硫酸铜的质量随时间变化如下图所示(不考虑其他因素对
烧杯中物质的影响)。下列判断错误的是()

| A. | 从0到t 3,烧杯中水的质量不断增加 |
| B. | t 1时与t 2时烧杯中物质总质量相等 |
| C. | 加入的金属一定是银 |
| D. | 从t 3到t 4,硫酸铜质量变化可通过置换反应实现 |
碘元素是人体必需的微量元素之一。

(1)右图是元素周期表中碘元素的部分信息。碘原子的核电荷数是
(2)已知某碘盐的主要成分为氯化钠和碘酸钾(
):
①氯化钠含有的阴离子是
②用试剂
测定该碘盐中碘元素的含量,发生如下反应:
,推算
的化学式为
③已知每包碘盐中最多含碘元素15
,则每包碘盐中最多含
的质量为
厦门某校在“国际化学年”中开展了以下趣味活动。
(1)“1+1<2”:将100 mL酒精与100 mL水充分混合后,体积小于200 mL。用分子的观点解释这一现象: 。两者混合过程发生 变化(填“物理”或“化学”)。
(2)“白纸显字”:取一张白纸,用酚酞写字,晾干后放在盛有浓氨水的试剂瓶口,立即显示出红色字迹。这一表演应用氨水的化学性质是 。
(3)“指纹鉴定”:向指纹上喷硝酸银溶液,指纹汗液中含有的氯化钠会转化成氯化银不溶物。写出这一反应的化学方程式: 。
(4)“火球跳舞”:加热硝酸钾至熔化,投入黄豆大的木炭,木炭由黑转红,在试管里不断上下跳动。写出发生反应的化学方程式:
①硝酸钾受热分解生成亚硝酸钾(KNO2)和氧气: 。
②木炭完全燃烧: 。
某城市住宅饮用水的处理过程如右图所示:

(1)步骤①网格净水原理类似于步骤(填"②"或"③"或"④"等序号)。
(2)步骤②所起的作用是(单选,填选项序号)。
| A. | 杀死水中的细菌 |
| B. | 减少水中氧气 |
| C. | 使泥沙沉积至底部 |
| D. | 分解有毒物质 |
(3)假如你是水质检验员,用简单的办法检验水样是否是硬水,可选用的试剂是;若检验时发现水硬度高,你建议在饮用前可采取的处理办法是。
(4)家庭净水器中含有大量的活性炭,活性炭起作用。
氯化钙是重要的化工原料。某工业碳酸钙所含的杂质主要是氧化铁及
一些不与酸碱反应的难溶性物质,以这种工业碳酸钙为原料生产氯化钙的主要流程如下图
所示:

(1)用化学方程式表示由碳酸钙生成氯化钙的反应原理:。
(2)步骤③得到的滤渣含有氢氧化铁,请写出步骤②发生复分解反应生成氢氧化铁的化学方程式:。
(3)步骤④加入盐酸的目的是除去;步骤⑤利用盐酸的性质,除去过量的盐酸。
为解决过度使用化石燃料造成的能源危机及环境问题,科学家提出如下图构想:

(1)水在催化剂和光照条件下分解可制得氢气,写出该反应的化学方程式:。
(2)垃圾中的有机物发酵得到沼气,写出沼气的主要成分燃烧的化学方程式:。
(3)科学家设想以燃烧产物中的
合成燃料
,这一反应可以缓解的环境问题是。
(4)氨气可在不同条件下与氧气反应生成不同的产物,且放出大量的热。若从环保角度考虑,氨气与氧气反应生成理想的产物是和。
实验室用过氧化氢溶液和二氧化锰制取氧气,发生装置如图所示:

(1)装置中仪器a名称是。
(2)写出上述方法制取氧气的化学方程式:。
(3)实验前,必须对该装置进行的操作是。
(4)若要得到干燥的氧气,可选用的干燥剂是,并用(填"向上"或"向下")排气法收集氧气。
(5)该实验中,可回收重复使用的药品是。
研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验。
实验一:比较两种物质的热稳定性
设计如右图装置:小试管套装在带有支管的大试管中,整套装置气密性好,其他装置略去。
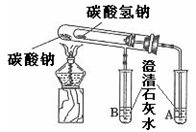
(1)为确保安全,实验结束时,在移离酒精灯前必须完成的操作是
(2)现象与结论:装有碳酸氢钠的试管口生成较多的无色小液滴,同时试管A中有大量的气泡产生,澄清石灰水变浑浊;试管B中也有气泡产生,澄清石灰水没有明显的变化;实验结束后,经检验大、小两试管内的物质均是碳酸钠。结合以上实验,可得出结论:①碳酸氢钠受热生成的物质是碳酸钠、
②在受热条件下,碳酸钠比碳酸氢钠稳定。
(3)反思与讨论:加热大试管时,碳酸钠的受热温度会高于碳酸氢钠。这能否准确地说明"在受热条件下,碳酸钠比碳酸氢钠稳定"这一结论?
实验二:比较与盐酸反应生成相同体积二氧化碳气体的快慢
取碳酸氢钠4.2 g放入如图Ⅰ装置的锥形瓶中,取碳酸钠5.3 g放入另一相同装置的锥形瓶中,分别加入相同质量、相同浓度的盐酸(足量)。相同的条件下,通过图Ⅱ装置测量出生成气体的体积,得到时间-体积关系曲线如图Ⅲ所示。
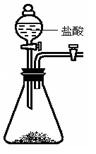
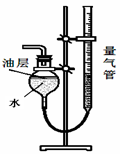
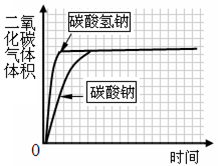
图Ⅰ 图Ⅱ 图Ⅲ
(4)已知二氧化碳不溶于该油层,图Ⅱ装置中油层的作用是
(5)数据与分析:根据图Ⅲ曲线,可得出有关"比较与盐酸反应生成相同体积二氧化碳气体的快慢"的结论是
(6)反思与讨论:实验中 "取碳酸氢钠4.2
、碳酸钠5.3
"的目的是

 粤公网安备 44130202000953号
粤公网安备 44130202000953号