2022年江苏省连云港市中考化学试卷
《天工开物》记载的下列造物过程中涉及化学变化的是( )
| A. |
棉线织布 |
B. |
粮食酿酒 |
C. |
楠木制舟 |
D. |
沙里淘金 |
常温下人体内一些液体的正常pH范围如下,其中呈酸性的是( )
| A. |
胃液(0.9~1.5) |
B. |
胆汁(7.1~7.3) |
| C. |
血液(7.35~7.45) |
D. |
胰液(7.5~8.0) |
阅读下列材料,回答以下小题:金属钠在一定条件下制取单质钛的化学方程式为 。将钛和钛合金放在海水中数年,取出后仍光亮如初。钠元素和钛元素在元素周期表中的相关信息如图所示。

(1)下列化学用语表示正确的是( )
| A. |
2个钠原子: |
| B. |
3个氯离子: |
| C. |
NaCl中Na元素的化合价: |
| D. |
钠原子结构示意图: |
(2)由金属钠制取单质钛的化学反应属于( )
| A. |
化合反应 |
B. |
分解反应 |
C. |
置换反应 |
D. |
复分解反应 |
(3)下列有关钛的说法不正确的是( )
| A. |
钛的原子序数为22 |
| B. |
钛属于金属元素 |
| C. |
钛合金抗腐蚀性比铁好 |
| D. |
钛的相对原子质量是47.87g |
中国科学家成功以二氧化碳和水为原料人工合成葡萄糖( )。下列说法正确的是( )
| A. |
葡萄糖由三种元素组成 |
| B. |
葡萄糖中含有水分子 |
| C. |
葡萄糖属于有机高分子 |
| D. |
葡萄糖中元素的质量比为 |
下列物质的性质与用途具有对应关系的是( )
| A. |
活性炭有吸附性,可用于净水 |
| B. |
石墨有导电性,可用于生产铅笔芯 |
| C. |
一氧化碳有可燃性,可用来炼铁 |
| D. |
碳酸钙难溶于水,可用作补钙剂 |
下列实验方案能达到实验目的的是( )
|
选项 |
实验目的 |
实验方案 |
|
A |
稀释浓 |
将水倒入浓 中并用玻璃棒不断搅拌 |
|
B |
鉴别 和 固体 |
取样,分别溶于水中,测量溶液温度的变化 |
|
C |
除去 固体中少量的 |
加入 固体,研磨 |
|
D |
检验蜡烛中是否含有氧元素 |
在蜡烛的火焰上方罩一只干燥烧杯,观察现象 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
和 的溶解度(如表)和溶解度曲线(如图)。下列说法正确的是( )
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度/g |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
|

| A. |
曲线甲代表 的溶解度曲线 |
| B. |
40℃时 饱和溶液中 的质量分数为63.9% |
| C. |
的值在20~30之间 |
| D. |
将 时甲和乙的饱和溶液升温至 时,溶液中溶质的质量分数:甲>乙 |
为探究一瓶久置的 溶液样品是否变质,进行如下实验:
实验一:取少量样品于试管中,滴加1~2滴酚酞溶液,溶液显红色。
实验二:取少量样品于试管中,加入适量稀硫酸,有气泡放出。
实验三:取少量样品于试管中,加入足量的 溶液,有白色沉淀生成。过滤,向滤液中滴加1~2滴酚酞溶液,溶液显红色。
下列结论正确的是( )
| A. |
实验一说明 溶液没有变质 |
| B. |
实验二说明 溶液全部变质 |
| C. |
实验三中生成的沉淀为 |
| D. |
实验三说明 溶液部分变质 |
一种利用太阳能分解水的原理如图所示。下列说法不正确的是( )

| A. |
反应Ⅰ的化学方程式: |
| B. |
理论上每生成2g ,同时生成32g |
| C. |
反应Ⅲ中生成 和 的分子个数比为 |
| D. |
反应Ⅰ、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变 |
2022年北京成功举办冬奥会,化学功不可没。
(1)冬奥会环保人员的服装面料是利用回收废弃的塑料瓶加工制成。
①塑料属于 (填字母)。
| A. |
a.金属材料 |
| B. |
b.复合材料 |
| C. |
c.合成材料 |
②回收废弃塑料可缓解 (填字母)。
| A. |
a.酸雨 |
| B. |
b.白色污染 |
| C. |
c.温室效应 |
(2)冬奥会火炬“飞扬”首次采用液氢作燃料。关于氢气液化的过程说法正确的是 (填字母)。
| A. |
a.氢分子的体积变小 |
| B. |
b.氢分子间的间隔变小 |
| C. |
c.氢分子的数目变少 |
(3)冬奥会上提供经过二氧化氯消毒处理的直饮水。
①二氧化氯的化学式为 。
②证明该直饮水是软水的实验方案为 。
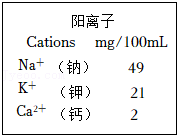
(4)冬奥会为运动员提供的某运动饮料包装标签部分说明如图。其中能预防骨质疏松、佝偻病的阳离子是 (填离子符号)。
连云港海洋资源丰富,应用前景广阔。
(1)海水晒盐。如图是利用海水提取粗盐的过程:

①“蒸发池”中质量逐渐减少的物质是 (填化学式)。
②实验室里除去粗盐中难溶性杂质一般步骤为溶解、过滤、蒸发,这三种基本操作中都要使用的玻璃仪器是 。
③析出晶体后的“母液”是氯化钠的 (选填“饱和溶液”或“不饱和溶液”)。母液中含有 ,向母液中加入澄清石灰水有白色沉淀生成,该复分解反应的化学方程式为 。
(2)海底探物。海底埋藏着大量的“可燃冰”,其主要成分是甲烷水合物(由甲烷分子和水分子组成),还含有少量的 等气体。
①下列说法正确的是 (填字母)。
a.可燃冰和干冰都属于混合物
b.可燃冰与煤相比是较清洁燃料
c.可燃冰和石油都属于可再生能源
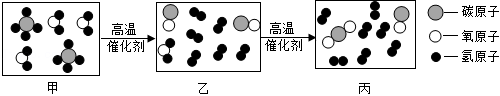
②利用 和 进行催化重整制氢气,反应前后分子变化的微观示意图如图所示。其中“乙→丙”发生反应的化学方程式为 。
是化学实验中常见试剂。
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的 溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有 溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为 。
步骤2:将铁钉浸入到 溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有 溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为 。
①用砂纸将铁钉打磨干净的作用是 。
②步骤2中可观察到明显的实验现象是 。该变化可说明 和 的金属活动性由强到弱的顺序是 。
③若 ,可证明参加反应的 和 的质量总和等于 。
(2)探究 溶液对 分解具有催化作用。
①若要证明 溶液对 分解具有催化作用,除需证明 在反应前后化学性质和质量不发生改变外,还需证明的是 。
②为探究 在反应前后质量是否发生改变,某同学设计如下实验:
向 溶液中滴入10g a%的 溶液,待反应完全后,向试管中加入足量的 溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为 。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物 计算出溶液中 的质量 。(填“大于”或“小于”或“等于”)
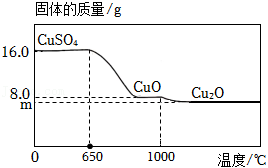
(3)将16.0g 置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
①650℃时, 开始发生分解反应,生成 和另一种氧化物 , 的化学式为 。
②1000℃时, 开始发生分解反应,生成 和 。计算图中 的值。(写出计算过程,否则不得分)
用图﹣1所示装置制取干燥的 ,并对 的部分性质进行探究。
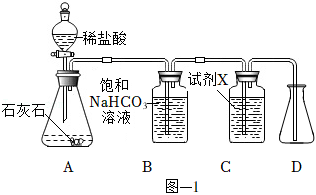
(1)装置A中发生反应的化学方程式为 。
(2)①装置B中饱和 溶液的作用是 。
②装置C中试剂 应该选用 (填字母)。
a.稀
b.浓
c. 溶液
(3)收集 并验满。将集满 的锥形瓶与盛有足量 溶液的注射器和传感器密封连接,缓慢的将 溶液注入到锥形瓶中,采集信息形成图像。见图﹣2。
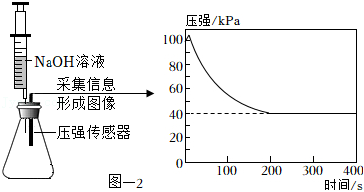
①检验装置D中 已经集满的方法是 。
②随着反应的进行,锥形瓶中压强降低的原因是 。
③反应结束后锥形瓶中的压强保持在 说明 。
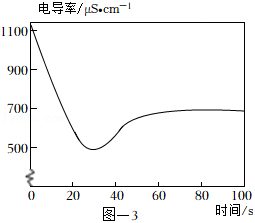
(4)取2mL饱和澄清石灰水于试管中,用4mL蒸馏水稀释,向其中缓慢通入足量 。测定反应体系的电导率变化如图﹣3所示。(忽略反应前后溶液体积的变化)
【查阅资料】
材料一:溶液的导电能力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三: 溶于水能完全解离出 和 。
遇到溶有 的水时,能反应生成易溶于水的 , 在水中能完全解离出 和 。
①石灰水中通入 气体,溶液的电导率先逐渐降低的主要原因是 。
②反应最终电导率的稳定值低于初始值的可能原因是 、 。

 取用
取用
 称量
称量
 量取
量取
 溶解
溶解
 粤公网安备 44130202000953号
粤公网安备 44130202000953号