2020年四川省成都市中考化学试卷
下列成都出土的文物中,不属于金属材料的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
成都围绕“人、城、境、业”开展公园城市示范区建设,相关举措有误的是( )
A.简约适度、低碳生活B.城园相融、人城和谐
C.水润天府、绿满蓉城D.减少污染、关停企业
根据如图实验,说法正确的是( )
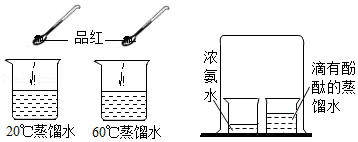
A.品红的扩散速度相同
B.浓氨水变红
C.氨水显碱性,pH大于7
D.分子运动速率与温度无关
化学与健康息息相关。下列说法正确的是( )
A.摄入足量的钙预防骨质疏松
B.缺乏维生素A会引起坏血病
C.工业用盐可代替食盐用于烹调
D.必需微量元素只能用药物补充
有关如图实验的说法正确的是( )
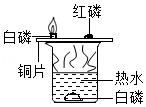
A.红磷会燃烧,产生大量白烟
B.向水中白磷通氧气,白磷会燃烧
C.热水的作用只是提供热量
D.可燃物温度达到着火点即可燃烧
下列物质的用途主要由物理性质决定的是( )
A.氧气用于医疗急救B.氦可用于制造低温环境
C.一氧化碳用于炼铁D.天然气用作燃料
科学家因锂离子电池发展的研究获诺贝尔化学奖。结合图示,有关锂的说法正确的是( )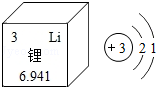
A.属于非金属元素B.相对原子质量是6.941g
C.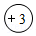 表示核内有3个电子D.离子符号是Li+
表示核内有3个电子D.离子符号是Li+
北京大学科研团队以炼钢废气为原料,实现了制备油品的新催化过程,反应过程如图所示。相关说法正确的是( )

A.制备的油品为纯净物
B.反应物不用和催化剂接触
C.反应实质是分子的重新组合
D.可处理有毒气体,具备工业应用价值
有关如图实验的说法正确的是( )

A.点燃氢气前不用检验纯度
B.干冷烧杯内壁无明显变化
C.b管气体能使带火星木条复燃
D.两个实验均可证明水的组成
实验时发生意外需及时处理。下列处理方法错误的是( )
A.过滤液体滤纸被戳破﹣﹣把玻璃棒靠在三层滤纸处
B.蒸发时食盐四处飞溅﹣﹣撤去酒精灯并不断搅拌
C.触碰热试管手被烫伤﹣﹣冷水冲洗后涂抹烫伤膏
D.氢氧化钠沾到皮肤上﹣﹣大量水冲洗后涂硼酸溶液
按如图进行实验,下列分析或结论正确的是(

A.导管口刚有气泡冒出说明反应开始
B.实验结束应立即倒出粉末
C.木炭能使氧化铜还原为铜
D.固体减少的质量一定等于生成CO2的质量
饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A.氢氧化铝B.氯化钠C.碳酸镁D.碳酸氢钠
忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是( )
选项 |
问题 |
分析与设计 |
A |
为何变质 |
2NaOH+CO2═Na2CO3+H2O |
B |
是否变质 |
取样,加入足量稀盐酸,观察是否产生气泡 |
C |
是否全部变质 |
取样,加入足量氯化钙溶液,观察产生沉淀多少 |
D |
如何除去杂质 |
取样,加入适量氢氧化钙溶液,过滤 |
A.AB.BC.CD.D
根据图文回答问题。

(1)面料中属于有机合成材料的是 。燃烧法可鉴别棉纤维与合成纤维,现象为 的是合成纤维。
(2)配料中富含糖类的是 (填一种)。真空包装可减缓食品缓慢氧化,缓慢氧化属于 (填“物理”或“化学”)变化。
(3)博物馆的主体建筑用铁板装饰,铁块制成铁板利用了铁的 性。防止铁板生锈的方法有 (写一条)。
(4)氢燃料电池把 能转化为电能。氢燃料电池的优点是 (填序号)。
a.产物是水,不污染空气
b.氢能源成本低
实验室里,常采用加热高锰酸钾或分解过氧化氢的方法制氧气。
(1)高锰酸钾属于 (填"酸"、"碱"或"盐"),用它制氧气的化学方程式是 。
(2)高锰酸钾制氧气的实验中,不需要使用的一组仪器是 (填序号)。
a.烧杯 玻璃棒
b.大试管 集气瓶
c.酒精灯 铁架台
d.导管 单孔塞
(3)利用化学方程式计算,制取4.8g氧气,至少需要过氧化氢的质量是多少?
配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
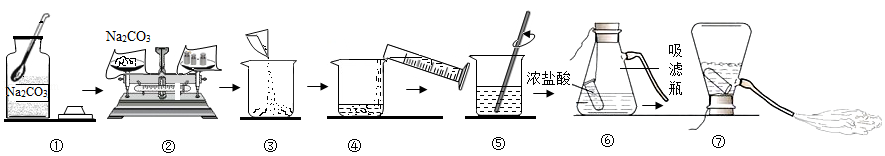
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
回答下列问题。
(1)从硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图:
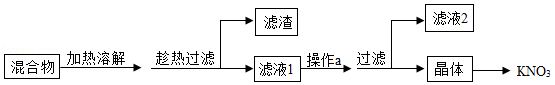
①结合如表分析,趁热过滤的原因是 。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
|
②操作a的名称是 。
③滤液2的溶质是 。
(2)A~D为初中化学常见物质,A、D为金属,在常温下通过如图所示转化可获取硝酸钾。回答下列问题。
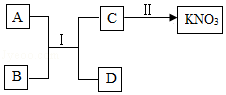
①反应Ⅰ能发生的原因是 。
②若D为银白色贵重金属,则反应i的化学方程式是 ,基本反应类型是 。
③一步实现反应Ⅱ,能否加入氯化钾?判断并说明理由 。
④硝酸钾可作化肥,能供给作物两种养分,属于 肥料。
化学兴趣小组对贝壳中碳酸钙的含量进行探究。
【提出问题】
如何选择药品和设计装置进行测定?
【查阅资料】
贝壳的主要成分是CaCO3,其它成分对实验影响忽略不计。
室温时,CaCO3不溶于水,CaSO4微溶于水。
【设计与实验】
实验一:选择药品
分别取等质量颗粒状和粉末状的贝壳样品与等体积、等浓度的稀盐酸在图1的三颈烧瓶中反应,采集数据。
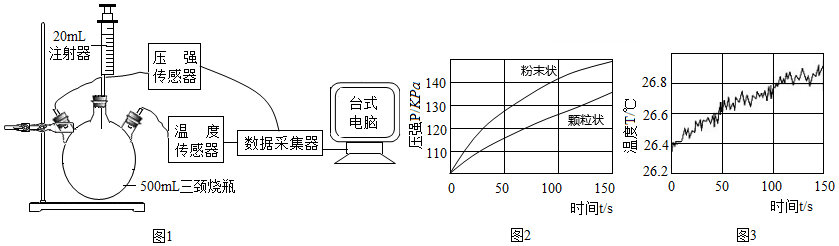
(1)图1中反应的化学方程式是 。
(2)据图2分析,选择粉末状样品的依据是 。
(3)据图3分析,影响实验测定准确性的原因:一是水蒸气含量增加;二是 。
实验二:设计装置

小组设计了图4装置进行测定。
(4)打开活塞,稀硫酸进入试管,观察到的现象是 。反应结束后进行读数。读数前调节水准管与量气管液面相平的原因是 。
实验三:优化装置
在老师指导下,小组优化并设计了图5装置进行测定。
(5)试剂a是 。
(6)检查该装置气密性的方法是 。
(7)加入足量稀硫酸,一段时间后反应停止。再加入氯化铵溶液,发现又产生气泡。推测加入氯化铵溶液的作用是 。
【数据处理】
(8)实验三中,样品质量为mg,加入稀硫酸体积为V1mL,加入氯化铵溶液体积为V2mL,右侧针筒最后读数为V3mL,则反应生成CO2体积为 mL.该实验条件下,CO2密度为dg/mL,则该样品中碳酸钙质量分数表达式为 。
【反思与评价】(9)与实验二相比,实验三的优点是 (写一条)。
 东汉说唱俑
东汉说唱俑 "郫"字青铜戈
"郫"字青铜戈 龙纹铅饼币
龙纹铅饼币 黄金面具
黄金面具 粤公网安备 44130202000953号
粤公网安备 44130202000953号