2020年江苏省苏州市中考化学试卷
下列有关化学用语表示正确的是( )
A.五氧化二磷:P2O5B.银元素:AG
C.2个镁离子:2Mg+2D.8个硫原子:S8
工业用反应2NaHCO3 Na2CO3+H2O+CO2↑来制备纯碱,该反应属于( )
A.分解反应B.化合反应C.置换反应D.复分解反应
下列有关氧气的说法中,不正确的是( )
A.氧气可供给呼吸
B.鱼类能在水中生存,说明氧气易溶于水
C.植物的光合作用是空气中氧气的主要来源
D.焊接或切割金属时使用纯氧代替空气以获得更高的温度
某净水装置如图所示。下列说法正确的是( )
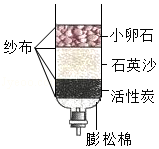
A.该装置能对水进行杀菌消毒
B.该装置能除去水中的颜色和异味
C.硬水经过该装置后可转化为软水
D.自来水经过该装置后可得蒸馏水
下列指定反应的化学方程式正确的是( )
A.镁条燃烧:Mg+O2 MgO
B.铜绿分解:Cu2(OH)2CO3 2CuO+CO2↑
C.氨水中和硫酸:NH3•H2O+H2SO4═NH4SO4+H2O
D.酒精完全燃烧:C2H6O+3O2 2CO2+3H2O
利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )

A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
下列物质的性质与用途具有对应关系的是( )
A.天然气难溶于水,可用作燃料
B.碳酸氢铵受热易分解,可用作化肥
C.石墨有导电性,可用于生产铅笔芯
D.小苏打能与盐酸反应,可用于治疗胃酸过多
下列关于溶液的说法正确的是( )
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水中加入蔗糖后形成溶液,导电性明显增强
下列各组离子在溶液中能大量共存的是( )
A.NH4+、SO42﹣、NO3﹣B.H+、Ba2+、OH﹣
C.Fe3+、Na+、OH﹣D.Ca2+、Cl﹣、CO32﹣
K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度/℃ |
20 |
40 |
50 |
60 |
80 |
|
溶解度/g |
K2CO3 |
110 |
117 |
121 |
126 |
139 |
KNO3 |
31.6 |
63.9 |
85.5 |
110 |
169 |
|
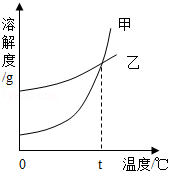
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100g KNO3饱和溶液中含63.9g KNO3
下列实验方案不能达到目的的是( )
A.鉴别:用熟石灰鉴别NH4Cl固体和NH4NO3固体
B.除杂:用浓硫酸除去O2中混有的少量水蒸气
C.检验:用高锰酸钾溶液检验CO2中是否混有SO2
D.制备:实验室用锌粒和稀硫酸制备少量H2
在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.C CO2 CO
B.S SO2 H2SO3溶液
C.Cu CuSO4溶液 Cu(OH)2
D.NaOH溶液 Na2CO3溶液 NaCl溶液
用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是( )

A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
化学与人类生活息息相关。请回答下列问题。
(1)化石燃料燃烧产生大量CO2,加剧了大气层的 效应。
(2)油锅起火可盖上锅盖使火熄灭,其灭火原理是 。
(3)大米中含有的糖类物质主要是 (填名称)。
(4)儿童患佝偻病、骨骼疏松是因为缺少 元素。
(5)用铁制作炊具是利用其良好的延展性和 性。
某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图1。

(1)如图1中仪器a的名称是 。
(2)用双氧水和MnO2制氧气。发生反应的化学方程式为 ,收集氧气的装置可选用 (填字母)。
(3)加热KClO3固体制氧气(1.5g MnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为:2KClO3 2KCl+3O2↑)
①发生装置应选用 (填字母)。
②KCl的溶解度曲线如图2所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解。至少应加入该温度下蒸馏水的体积约 (填字母)。

a.5mL
b.10mL
c.20mL
d.30mL
③对溶解所得混合物进行过滤,滤渣经处理得MnO2,从滤液中获得KCl晶体的最佳方法是 。
铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为 (填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和 (写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式: 。
(3)用砂纸去除铝片表面的氧化膜。将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式: 。
②硫酸铜溶液中的阳离子有 (填离子符号)。
(4)原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号: 。
[铝原子的结构示意图为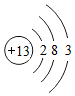 ]
]
阅读下面的科普短文,回答相关问题。
氨是一种重要的化学物质,可用于制造硝酸和氮肥,氨主要来自于人工合成。1909年,弗里茨•哈伯成功地利用氮气和氢气合成出氨。工业合成氨的流程如图1所示。
为了找到合成氨反应合适的催化剂,人们做了6500多次实验,发现铁触媒效果较好。在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨,当容器中氨的含量不再发生变化时(平衡时),测得氨的含量分别与温度和压强的关系如图2所示。
1913年第一座合成氨工厂建立。如今全球合成氨年产量超千万吨,其中大约85%的氨用于生产氮肥,缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
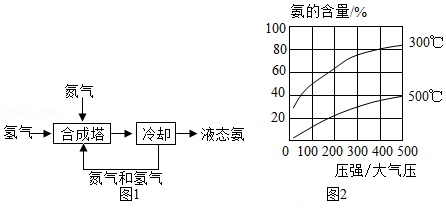
(1)工业上可用 方法获得合成氨的原料N2。
(2)甲烷和H2O高温下反应得到CO和原料气H2,该反应的化学方程式为 。
(3)从“合成塔”中出来的气体是 (填“纯净物”或“混合物”)。
(4)科学家研究合成氨反应催化剂的目的是 。
(5)按下列条件进行合成氨反应,平衡时氨的含量最高的是 (填字母)。
a.200大气压、300℃
b.200大气压、500℃
c.400大气压、300℃
d.400大气压、500℃
氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。
Ⅰ.氢气的制取
(1)科学家正致力于研究在催化剂和光照条件下分解水制氢气。写出该反应的化学方程式: ,该反应 (填“放出”或“吸收”)能量。
(2)水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。
图中曲线A、B对应的微粒依次是 (填符号)。
Ⅱ.氢气的储存
(3)一种镁铜合金可用于储氢。
①将镁、铜单质按比例在一定温度下熔炼得到上述合金。熔炼时须通入氩气,其目的是 。
②350℃时,该镁铜合金与氢气反应,生成了一种仅含Mg、H两种元素的化合物,其中氢元素的质量分数为7.7%.该化合物的化学式为 。
硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如图:
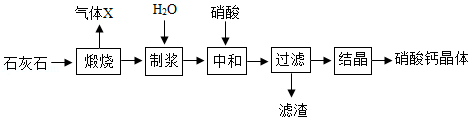
已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填字母)。
a.溶液 b.悬浊液 c.乳浊液
(3)写出“中和”步骤主要反应的化学方程式: 。
(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和 。
(5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致 。
(6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低,同时会产生污染气体NOx.产生NOx的原因是 。
碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用。
[配制溶液]配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是 (填字母)。
a.用托盘天平称取2g Na2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 |
Ⅰ |
Ⅱ |
III |
溶质质量分数 |
1% |
2% |
4% |
溶液pH |
11.62 |
11.76 |
11.90 |
分析Ⅰ、Ⅱ、Ⅲ三组数据可得出的结论是 。
[制备物质]用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
[已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀]
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2═4X+4CO2.则X的化学式为 。
[标定浓度]标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于lg•mL﹣1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将 (填“偏大”、“偏小”或“无影响”)。
钢铁的腐蚀是重要研究课题。
[知识回顾]用如图1所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。

(1)由A、B、C的现象可知,铁的锈蚀是铁跟 (填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是 。
[实验探究]向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式: 。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如表3个实验(持续10小时,已知氢气不影响该反应)
序号 |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
实验内容 |
|
|
|
现象 |
溶液颜色始终呈黄色 |
产生红褐色沉淀 |
溶液逐渐由黄色变浅绿色 |
①设计实验Ⅰ的目的是 。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是 。
[拓展延伸]研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。

(5)图2表示水样温度22℃、氧含量6mL•L﹣1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是 。
(6)图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL•L﹣1时,钢铁腐蚀速率明显下降的原因可能是 。
 B.
B.
 D.
D.
 加热液体B.
加热液体B. 测定pH
测定pH 滴加液体D.
滴加液体D. 检查气密性
检查气密性


 粤公网安备 44130202000953号
粤公网安备 44130202000953号