2020年湖南省张家界市中考化学试卷
我国传统文化源远流长。下列文化技艺中一定发生化学变化的是( )
A.制作泥塑B.扎制风筝C.编中国结D.烧制瓷器
空气是一种宝贵的自然资源。下列有关空气的说法中不正确的是( )
A.植树造林、种草,可以保护空气
B.氧气在空气中的体积分数为78%
C.氮气在焊接金属时常用作保护气
D.空气中二氧化碳的含量是相对稳定的
下列做法不符合“绿色环保”与“个人幸福感”理念的是( )
A.用布袋替代塑料袋
B.随意燃放烟花爆竹
C.生活垃圾分类处理
D.外出尽量步行或骑自行车
我市盛产多种野生菌。行走在大山里,能闻到某些野生菌散发出的特殊香味,主要是因为( )
A.分子可以再分
B.分子之间有间隔
C.分子在不断运动
D.分子的质量和体积都很小
强化健康意识,保障“舌尖上的安全”。下列说法不正确的是( )
A.青少年喝牛奶,可以预防佝偻病
B.可用工业用盐亚硝酸钠烹调食物
C.控制油脂摄入可以减少肥胖的发生
D.甲醛溶液浸泡过的海产品不能食用
化学用语是国际通用语言,是学习化学的重要工具,下列化学用语表示不正确的是( )
A.氮元素:NB.一个铁原子:Fe
C.干冰:H2OD.二个氧分子:2O2
在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
氢气作为清洁能源,越来越受到人们的关注。我国科学家寻找到一种新型催化剂,能使一氧化碳和水在低温条件下反应产生氢气,反应过程如图所示。下列说法正确的是( )

A.H2是不可再生能源
B.反应物和生成物均为化合物
C.使用催化剂可以改变化学反应条件
D.化学反应前后,分子的种类、数目均不变
物质的鉴别和除杂是重要的实验技能,下列实验方法不能达到实验目的的是( )
选项 |
实验目的 |
实验方法 |
A |
验证铁比银的金属活动性强 |
将Fe丝插入AgNO3溶液中 |
B |
除去NaCl固体中少量的CaCO3 |
溶解、过滤、蒸发、结晶 |
C |
鉴别CuO和炭粉 |
加入盐酸,观察现象 |
D |
鉴别O2、CO2、N2 |
用燃着的木条检验 |
A.AB.BC.CD.D
我国在抗击新冠肺炎疫情中,为全世界做出了贡献。从化学视角认识抗疫中的事物,并回答下列问题。
(1)佩戴口罩是防止病毒传播的有效途径之一。聚丙烯高分子化合物是制作口罩的材料,它属于 (选填“金属”或“合成”)材料。
(2)我市市民积极向武汉疫区捐献鸡蛋、蔬菜、水果、大米等物资,请你说出其中一种富含维生素的物质是 。
(3)公共场所常用84消毒液(有效成分为次氯酸钠(NaClO)杀菌消毒。
①氯元素的原子结构示意图为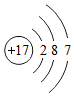 在化学反应中氯原子容易 电子(选填“得到”或“失去”)。
在化学反应中氯原子容易 电子(选填“得到”或“失去”)。
②次氯酸钠(NaClO)中氯元素的化合价为 。
③84消毒液具有较强的腐蚀性和漂白作用,使用时应注意 (答一点即可)。
水是生命之源,是人类生产生活中不可缺少的物质。我们通过一年的化学学习,进一步加深了对水的认识。请回答下列问题。
(1)生活中常用 的方法降低水的硬度,并能起到杀菌消毒的作用。
(2)关于H2O、H2O2化学性质不同的主要原因是 (选填“元素组成”或“分子结构”)不同。
(3)在农业生产中,常用溶质质量分数为3%的KNO3溶液作无土裁培的营养液,配制100kg该营养液需要水的质量是 kg。
(4)通常情况下,铜长期暴露在潮湿空气中会生锈,即生成铜绿[Cu2(OH)2CO3],这是铜与氧气、二氧化碳和 反应的产物。
(5)习近平提出:“绝不容许生态环境继续恶化,要给子孙后代留下一条清洁美丽的万里长江,”请你提出一条保护水资源的合理化建议 。
2020年中国首次火星探测,利用火星车一次实现“环绕、着陆、巡视”三个目标,这是其他国家第一次实施火星探测从未有过的,面临的挑战也是前所未有的。(火星车模型如图)。
(1)硅片太阳能电池板在日光照射下或跟空气、水分接触时都不容易发生反应,则硅必备的化学性质 (选填“较活泼”或“稳定”)。
(2)火星车采用钛合金、铝合金、复合记忆纤维等材料制造,为保证火星车在火星上着陆并正常工作,钛、铝合金应具有密度小、硬度 、耐腐蚀等优良性能;铝的化学性质很活泼,但铝制品却很耐腐蚀的原因是 。
(3)火星大气中二氧化碳含量高,二氧化碳在一定条件下能发生反应生成一氧化碳和氧气,该反应的化学方程式 ,所属的基本反应类型为 ,生成的一氧化碳可解决火星探测器的燃料问题。

如图是实验室制取气体的部分装置,回答有关问题。

(1)指出图中标示的仪器名称:a 。
(2)实验室若选用B装置制备氧气,反应的化学方程式 。收集氧气可选择的装置 (填一个序号)。
(3)实验室制取二氧化碳时,常选用C装置收集气体,证明是否集满的方法是 。
利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):
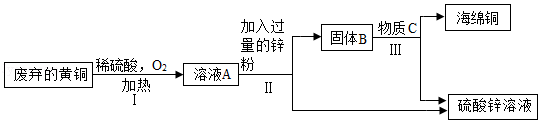
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
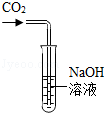
某化学兴趣小组在探究氢氧化钠的化学性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究。
探究一:二氧化碳是否与氢氧化钠溶液发生了化学反应?
取少量大试管中的液体,滴加足量的稀盐酸,观察到 ,证明二氧化碳与氢氧化钠发生了反应。
探究二:反应后大试管中溶液所含溶质的成分是什么?
[查阅资料]
1、CO2与碳酸钠溶液反应:Na2CO3+CO2+H2O═2NaHCO3
2、NaHCO3溶液呈碱性,能与NaOH反应,且与澄清石灰水反应生成白色沉淀
3、BaC12溶液呈中性,与Na2CO3反应生成白色沉淀,与NaHCO3不发生反应
小组成员经过分析讨论,一致认为溶质的成分为Na2CO3、NaHCO3、NaOH中的一种成几种。
[猜想假设]
猜想一:NaOH、Na2CO3
猜想二:Na2CO3
猜想三:
猜想四:NaHCO3
[实验探究]
序号 |
实验操作 |
实验现象 |
① |
取一定量大试管中的溶液于试管中,加入足量的BaCl2溶液 |
产生白色沉 |
② |
过滤 |
/ |
③ |
取一定量的滤液于试管中,加入澄清石灰水 |
没有明显现象 |
④ |
取一定量的滤液于另一支试管中,滴加适量酚酞溶液 |
|
[实验结论]
根据观察到的实验现象得出猜想 成立。
[实验反思]
化学反应是否发生,可以借助反应过程中伴随的实验现象来判断:也可以借生成物的性质来判断。
被称为“活化石”的银杏树在我市随处可见,银杏果中富含的银杏酸(化学式为C22H34O3)具有较高的药用价值。请你计算:
(1)银杏酸的相对分子质量 ;
(2)银杏酸中碳元素与氧元素的质量比 。
 稀释浓硫酸B.
稀释浓硫酸B. 倾倒液体
倾倒液体 点燃酒精灯D.
点燃酒精灯D. 滴加液体
滴加液体 粤公网安备 44130202000953号
粤公网安备 44130202000953号