2020年北京市中考化学试卷
不同温度下KNO3的溶解度如下表所示。下列说法正确的是( )
温度/℃ |
20 |
30 |
40 |
溶解度/g |
31.6 |
45.8 |
63.9 |
A.20℃时,100g KNO3饱和溶液中溶质质量为31.6g
B.30℃时,100g KNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50g KNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9g KNO3
利用如图装置验证了空气中氧气的含量。下列叙述不正确的是( )
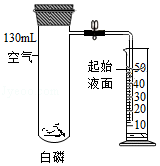
A.实验前需检查装置气密性
B.白磷的作用是消耗试管中的氧气
C.白磷熄灭、试管冷却后再打开止水夹
D.最终量筒中液面约降至40mL刻度线处
甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如图:

下列说法正确的是( )
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。
(1)配平化学方程式: NaClO2+ Cl2═ ClO2+ NaCl。
(2)71g Cl2完全反应,理论上最多生成ClO2的质量为 g。
我国大力推广在盐分高,pH>9的土壤中种植海水稻。
(1)pH>9的土壤呈 (填“酸性”或“碱性”)。
(2)大米中主要含有的营养素是 。
(3)稻壳可用于制纳米SiO2,SiO2属于 (填序号)。
A.氧化物
B.化合物
C.混合物
阅读下面科普短文。
氢能是公认的高热值清洁能源。目前,氢气的来源如图1所示。
化石资源制氢最为成熟。水煤气变换反应:CO+H2O CO2+H2,是化石资源制氢过程中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。
电解水制氢过程简便,但造价高昂,利用太阳能制氢是未来的发展方向,“人造太阳”的探索也就应运而生。我国“人造太阳”大科学装置“东方超环”利用的是核聚变,当氘、氚核聚变温度达到1亿摄氏度、持续时间超过1000秒,就能形成持续反应,为水分解提供能量。2020年4月,“东方超环”实现了1亿摄氏度运行近10秒,取得重大突破。

除了氢气的生产,其运输、储存和利用等仍面临诸多挑战,需要人们不断探索。
依据文章内容回答下列问题。
(1)目前氢气的主要来源是 。
(2)图2中,催化剂为2% Au/α﹣MoC时,CO转化率和温度的关系是 。
(3)根据下表信息可知氘、氚都属于氢元素,理由是 。
原子种类 |
质子数 |
中子数 |
核外电子数 |
氘 |
1 |
1 |
1 |
氚 |
1 |
2 |
1 |
(4)下列说法正确的是 (填序号)。
A.α﹣MoC可使CO转化率接近100%
B.水电解制氢的不足是造价高昂
C.利用太阳能制氢是未来发展方向
D.“东方超环”利用核聚变提供能量
CuO是某种无机胶黏剂的组分之一,制备的部分流程如图。
已知:CuO难溶于水。

(1)反应釜中发生的反应有:
①2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
②Cu(OH)2 CuO+H2O
其中,属于复分解反应的是 (填“①”或“②”)。
(2)过滤器分离出的滤液中一定含有的溶质是 。
从氯碱工业产生的盐泥中回收BaSO4,其主要工艺流程如图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。

(1)除去NaCl,利用的性质是 。
(2)酸溶槽中发生中和反应的化学方程式为 。
(3)过滤器中分离出来的固体是 。
下列是两个关于水的实验。

(1)实验1,反应的化学方程式为 。
(2)下列说法正确的是 (填序号)。
A.实验1,试管a中得到的气体能燃烧
B.实验1,反应前后原子的种类、个数均改变
C.实验2,水变化前后分子的种类不变
补全实验报告。
装置及操作 |
现象 |
解释或结论 |
|
|
(1)向1中滴加 溶液 |
铁片上附着红色固体,溶液颜色变浅 |
Fe的金属活动性比Cu的强 |
(2)向2中滴加盐酸 |
固体减少,得到黄色溶液 |
化学方程式:
|
|
(3)向3中滴加足量盐酸 |
|
Ca(OH)2能与盐酸反应 |
|
从如图选择仪器,配制60g溶质质量分数为10%的NaCl溶液。

(1)需要称量NaCl的质量为 g。
(2)量取水用到的仪器有 (写名称)。
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为 。
验证可燃物燃烧的条件。已知:白磷、红磷的着火点分别是40℃、240℃。
装置(夹持仪器已略去) |
步骤及现象 |
|
Ⅰ.将一定量的白磷、红磷分別浸入80℃热水中(如图所示)。白磷、红磷均不燃烧 Ⅱ.升高右侧漏斗至红磷露出水面。红磷不燃烧 Ⅲ.升高左侧漏斗至白磷露出水面。白磷燃烧 |
(1)Ⅰ中白磷不燃烧的原因是 。
(2)对比Ⅱ和Ⅲ,可验证可燃物燃烧的条件是 。
丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
[进行实验]用如图装置(夹持仪器已略去)完成实验,记录如下:
序号 |
① |
② |
装置 |
|
|
现象 |
试管内壁有水雾 |
注入酸后,有气泡产生,石灰水变浑浊 |
[解释与结论]
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为 。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是 。
Ⅱ.探究丙酸钙防霉的效果
[进行实验]分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 |
第1组 |
第2组 |
|||||||
序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
配方 |
面粉/g |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
酵母/g |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
|
蔗糖/g |
0 |
0 |
0 |
0 |
5 |
5 |
x |
5 |
|
丙酸钙/g |
0 |
0.06 |
0.10 |
0.15 |
0 |
0.06 |
0.10 |
0.15 |
|
开始发霉时间 |
第3天 |
第4天 |
第5天 |
第6天 |
第3天 |
第4天 |
第5天 |
第6天 |
|
[解释与结论]
(3)设计第1组实验的目的是 。
(4)第2组,⑦中x为 。
(5)对比第1组、第2组实验可得到的结论是 。
[反思与评价]
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”,你是否同意此观点,并说明理由: 。
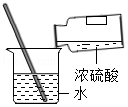 稀释浓硫酸B.
稀释浓硫酸B. 点燃酒精灯
点燃酒精灯 加热液体D.
加热液体D. 取用固体粉末
取用固体粉末





 粤公网安备 44130202000953号
粤公网安备 44130202000953号