2019年江苏省苏州市中考化学试卷
2019年“世界环境日”中国确定的主题是“蓝天保卫战,我是行动者”。下列做法与之相违背的是( )
A.秸秆露天焚烧B.废气达标排放
C.工地洒水除尘D.禁放烟花爆竹
下列有关化学用语表示正确的是( )
A.葡萄糖:C6H12O6B.钠原子结构示意图
C.2个锌离子:2Zn+2D.60个碳原子:C60
下列关于氧气的说法正确的是( )
A.分离液态空气获得氧气是化学变化
B.植物的光合作用会消耗氧气
C.通常情况下,氧气的化学性质不活泼
D.液态氧可用作火箭助燃剂
工业用2Mg+TiCl4 2MgCl2+Ti来冶炼金属钛,该反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
下列说法正确的是( )
A.铁是地壳中含量最多的金属元素
B.铁制品在潮湿的空气中容易生锈
C.多数合金的熔点高于它的成分金属
D.铝制品在空气中耐腐蚀是因为铝不活泼
下列说法不正确的是( )
A.纤维素由碳、氢、氧三种元素组成
B.葡萄糖在人体内缓慢氧化释放热量
C.蛋白质受热凝固属于化学变化
D.淀粉和油脂都是有机高分子化合物
下列各组离子在溶液中能大量共存的是( )
A.K+、SO42﹣、NO3﹣B.NH4+、OH﹣、Cl﹣
C.Cu2+、Na+、OH﹣D.Ca2+、K+、CO32﹣
下列说法符合安全要求的是( )
A.家中燃气泄漏,立即开灯检查
B.稀释浓硫酸时,将水沿烧杯壁缓缓注入盛有浓硫酸的烧杯中
C.不慎碰倒酒精灯,洒出的酒精在桌上燃烧,立即用水浇灭
D.逃离火灾现场时,可用湿毛巾捂住口鼻,并尽量贴近地面
原子是构成物质的一种重要微粒。下列有关原子的说法中正确的是( )
A.原子的质量主要集中在原子核上
B.相同的原子无法构成不同的分子
C.温度升高,温度计内汞柱液面上升说明汞原子体积变大
D.原子呈电中性是因为原子中质子数与中子数相等
实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法正确的是( )
A.托盘天平未经调零即用来称取氯化钠固体
B.称量时托盘天平指针偏左,移动游码至天平平衡
C.量取水时,用规格为50mL的量筒
D.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
下列有关CO2实验的图示正确的是( )
A. 制取CO2
制取CO2
B. 收集CO2
收集CO2
C. 验证CO2已集满
验证CO2已集满
D. 验证CO2能与水反应
验证CO2能与水反应
下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
鉴别下列各组物质,所选用的试剂不正确的是( )
A.面粉和米粉:碘酒
B.NaOH固体和NH4NO3固体:水
C.硬水和软水:肥皂水
D.NaCl溶液和NaNO3溶液:AgNO3溶液
下列物质的性质与用途具有对应关系的是( )
A.活性炭具有可燃性,可用于净化饮用水
B.镁有银白色金属光泽,可用于制作烟花
C.小苏打可溶于水,可用于治疗胃酸过多
D.熟石灰具有碱性,可用于改良酸性土壤
除去下列物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )
选项 |
物质(括号内为杂质) |
试剂及操作方法 |
A |
CO2(H2O) |
通过装有生石灰的干燥管,干燥 |
B |
KCl固体(MnO2) |
加水溶解、过滤、蒸发滤液 |
C |
Fe粉(Cu粉) |
加入过量稀硫酸,过滤 |
D |
NaCl溶液(MgCl2) |
加入过量NaOH溶液,过滤 |
A.AB.BC.CD.D
如图是某反应的微观示意图。下列说法不正确的是( )
A.反应后硫元素化合价升高
B.生成物均为氧化物
C.反应后分子总数减少
D.参加反应的甲、乙分子个数比为1:2
下列物质的转化在给定条件下均能实现的是( )
A.S SO3 H2SO4
B.CaCO3 CO2 CO
C.Cu Cu(NO3)2 CuSO4
D.Na2SO4 Na2CO3 NaOH
将草酸(H2C2O4,沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法不正确的是( )

A.若甲试管内溶液变浑浊,则M中一定含有CO2
B.若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO
C.若装置甲、乙位置互换,则无法判断M中是否含有CO
D.若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气
化学与人类生活、生产息息相关。请回答下列问题。
(1)天然气的主要成分是 。
(2)人体缺少 元素会导致甲状腺疾病。
(3)用洗洁精除去油污,是由于洗洁精对油污有 作用。
(4)用 试纸可粗略测定酸果汁的酸碱度。
(5) (填"聚乙烯"或"聚氯乙烯")薄膜可用于食品的包装。
根据下列反应事实写出相应的化学方程式。
(1)红磷在空气中燃烧: 。
(2)铁钉浸入硫酸铜溶液: 。
(3)二氧化碳通入澄清石灰水: 。
(4)稀盐酸除去铁锈: 。
硝酸钾的溶解度曲线如图所示。
(1)30℃时,硝酸钾的溶解度是 。
(2)60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是 (填“饱和”或“不饱和”)溶液。
②将上述溶液降温至30℃,可析出硝酸钾晶体 g,此时溶液的溶质质量分数 (填“>”、“=”或“<”)45.8%。

实验室常用高锰酸钾制取氧气,可能用到的装置如图所示。
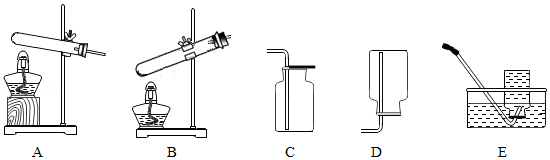
(1)本实验可选用的发生和收集装置为 (填字母)。
(2)①写出高锰酸钾分解制氧气的化学方程式: 。
②上述反应的理论产氧率为 [产氧率 100%,结果精确到0.1%]。
③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因有 (测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2.下列操作正确的是 (填字母)
a.未检查装置气密性即向大试管中加入高锰酸钾固体
b.当导管口有连续气泡均匀冒出时,开始收集氧气
c.集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d.气体收集完毕后,先熄灭酒精灯,再将导管移出水面
(4)实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
MnO2用量/g |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
所用时间/s |
17 |
8 |
6 |
3 |
2 |
2 |
2 |
2 |
2 |
①写出上述反应的化学方程式: 。
②该实验可得出的结论是 。
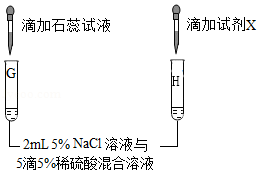
某同学设计如下几组实验,探究某些酸、碱、盐之间的复分解反应能否发生。
已知:BaSO4是白色固体,难溶于水,也不与盐酸反应。
【第一组】选取5种溶液,如图所示进行实验。
实验 |
现象及结论 |
解释 |
|
试管A和B中无明显现 象,不能确定反应是否 发生。 |
/ |
(1)试管C中产生 (填实验现象)。复分解反应已发生。 |
(2)试管C中减少的微粒是 (填微粒符号) |
|
试管D中有白色沉淀产生。复分解反应已发生。 |
(3)反应的化学方程式为 |
【第二组】对试管A和B中是否发生反应再探究,如图所示进行实验。
实验 |
现象及结论 |
解释 |
|
试管E中,滴加酚酞试液 后,溶液由无色变为红色; 滴加一定量稀硫酸后,溶 液由红色变为无色。 复分解反应已发生。 |
(4)从微观粒子变化的角 度分析试管E中反应的实 质是 。 |
试管F中始终无明显现象, 不能确定反应是否发生。 |
/ |
【第三组】对试管B中是否发生反应继续探究,如图所示进行实验。
实验 |
现象及结论 |
解释 |
|
试管G中溶液变红 |
(5)该实验的目的是为了检验试管G的溶液中存在 (填微粒符号)。 |
(6)向试管H中滴加 (填“试剂X”的化学式)溶液后,有白色 沉淀产生。 |
溶液中有SO42﹣存在。 |
|
结论 |
NaCl溶液与稀硫酸不发生复分解反应。 |
|
实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O.其主要实验过程如图:

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为 和 。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有 (填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。 (填“能”或“否”),理由是 。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是 。
维C泡腾片是一种常见的补充维生素C的保健品。某品牌维C泡腾片(以下称“本品”)的主要成分如图1所示。
(1)下列关于维生素C的说法正确的是 (填字母)。
a.维生素C由C、H、O三种元素组成
b.维生素C的相对分子质量为176g
C.维生素C由6个碳原子、8个氢原子和6个氧原子构成
d.维生素C中C、H、O元素的质量比为9:1:12
(2)阅读本品的营养成分表:每100g维C泡腾片含钠5750mg(1mg=10﹣3g)。已知本品其他成分不含钠元素,则本品中碳酸氢钠的质量分数为 。
(3)维C泡腾片水溶液酸碱性的测定:将本品一片投入蒸馏水中,有气泡产生,反应原理为:H3C6H5O2+3NaHCO3=Na3C6H5O2+3CO2↑+3 (填化学式)。
待不再产生气体后,测得溶液呈酸性。
(4)维C泡腾片中碳酸氢钠质量分数的测定:称量相关实验用品质量,将本品一片投入蒸馏水中,待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图2所示。
相关数据如表:
物品 |
反应前 |
反应后 |
||
锥形瓶 |
蒸馏水 |
维C泡腾片 |
锥形瓶及瓶内所有物质 |
|
质量/g |
71.75 |
50.00 |
4.00 |
125.53 |
①根据以上数据计算本品中碳酸氢钠的质量分数(写出计算过程,结果精确到0.1%)。
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是 。

水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。

(1)1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是 (填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
(2)1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为 。该反应若生成1g氢气,则理论上铁制枪管应增重 g。
实验发现枪管实际增重比理论数值大,其可能的原因是 。
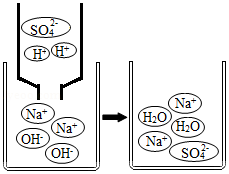
(3)1800年,英国化学家尼科尔森通过电解水得到氢气和氧气,后人不断研究和改进该实验。现有某同学在水电解器中加入含酚酞的稀Na2SO4溶液,至充满管A和管B(Na2SO4溶液呈中性且不参与反应)。通直流电一段时间后现象如图2所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是 (填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣,可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有 (填微粒符号)。
(4)当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图3所示。

注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是 、 。
 长颈漏斗B.
长颈漏斗B. 试管夹C.
试管夹C. 滴瓶D.
滴瓶D. 蒸发皿
蒸发皿
 取用粗盐B.
取用粗盐B. 溶解粗盐
溶解粗盐 过滤粗盐水D.
过滤粗盐水D. 蒸干滤液
蒸干滤液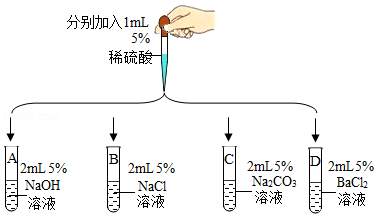

 粤公网安备 44130202000953号
粤公网安备 44130202000953号