2016年山东省日照市中考化学试卷
化学与人们的生活密切相关.下列叙述正确的是( )
| A. |
废旧塑料随意丢弃,导致白色污染 |
| B. |
人体缺乏维生素C,引发夜盲症 |
| C. |
铝合金比铁制品耐腐蚀,是因为铝的化学性质不如铁活泼 |
| D. |
空气中二氧化碳含量不断上升,导致了酸雨 |
化学实验过程必须高度重视实验安全.以下做法不合理的是( )
| A. |
使用酒精灯时不慎打翻着火,迅速用湿布盖灭 |
| B. |
浓硫酸不慎溅到皮肤上,迅速抹上碳酸氢钠稀溶液,然后用大量水冲洗 |
| C. |
把玻璃管插入带孔橡胶塞时,拿布包住用水湿润的玻璃管稍稍用力旋转插入 |
| D. |
易燃物和易燥物不能跟其他物质混存,盛装的容器要牢固、密封 |
三氧化铬(CrO 3)是酒驾测试仪中的主要试剂,能与酒精(C 2H 5OH)发生反应.下列说法错误的是( )
| A. |
CrO 3中铬元素的化合价为+6 |
B. |
CrO 3属于纯净物 |
| C. |
C 2H 5OH中C、H、O的原子个数比为2:5:1 |
D. |
C 2H 5OH的相对分子质量为46 |
下列操作或反应所对应的曲线正确的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
由下列实验操作和现象得出的结论正确的是( )
选项 |
实验操作 |
实验现象 |
结论 |
A |
用湿润的蓝色石蕊试纸检验某气体 |
蓝色石蕊试纸变红 |
气体一定是HCl |
B |
向水垢[主要成分是CaCO 3和Mg(OH) 2]中加入稀硫酸 |
仍然有固体存在 |
硫酸与水垢不反应 |
C |
向石灰水中加入醋酸 |
没有明显变化 |
二者不发生反应 |
D |
把盐酸滴加到大理石板上 |
放出气体 |
盐酸酸性比碳酸强 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列关于反应类型和物质类别的判断不完全正确的是( )
选项 |
化学方程式 |
反应类型 |
所选物质类别 |
A |
2KClO 3 |
分解反应 |
KClO 3是氧化物 |
B |
3C+2Fe 2O 3 |
置换反应 |
Fe是金属单质 |
C |
4NO 2+O 2+2H 2O═4HNO 3 |
化合反应 |
HNO 3是酸 |
D |
FeCl 3+3NH 3•H 2O=Fe(OH) 3↓+3NH 4Cl |
复分解反应 |
NH 3•H 2O是碱 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列仪器的使用或操作准确无误的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
如图为某密闭容器中物质变化的微观示意图("●"代表碳原子,"○"代表氧原子),有关叙述错误的是( )

| A. |
过程 I 反应类型为化合反应 |
B. |
过程 I 反应后分子总数减少 |
| C. |
过程 II 发生了化学变化 |
D. |
排列再紧密的分子之间也有间隙 |
足量的镁、铁分别和等量的盐酸反应,产生的氢气质量与时间的关系如图所示,下列说法不正确的是( )

| A. |
t 1时,产生氢气的质量镁比铁多 |
B. |
t 2时,镁、铁消耗的盐酸质量相同 |
| C. |
t 2时,镁、铁与盐酸都恰好完全反应 |
D. |
t 3时,参加反应铁的质量是56 g |
如图所示是两种元素在元素周期表中的信息.
(1)、氧元素的原子序数是 .
(2)、氢元素属于 (填"金属"或"非金属")元素.
(3)、氢元素和氧元素组成的两种化合物分别是 和 .(写化学式)
如图中各物质均为初中化学常见物质,其中A为黑色非金属单质,D、G为金属单质且G为紫红色,B是导致温室效应的主要气体,C是一种有毒气体,反应 ①是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
(1)反应①的化学方程式是 。
(2)反应②的化学方程式是 。
(3)F物质的化学式是 。
(4)在②中若加入的硫酸过量,则在反应③中还会产生一种非金属单质是 。

A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题.
(1)t 1℃时,A、B、C三种物质的溶解度由大到小的顺序是 .
(2)t 2℃时,在A物质的饱和溶液中溶质与溶剂的质量最简比为 .
(3)t 3℃时,100g水中溶解60g B刚好饱和,那么50g 水中溶解 g C也刚好达饱和.
(4)当A中混有少量B时,可用 (填"降温结晶"或"蒸发结晶")方法提纯A.

我国制碱工业先驱侯德榜先生发明了将制碱与制氨结合起来的联合制碱法,大大提高了原料利用率.其模拟流程如下:

(1)反应 ①的化学方程式是 .
(2)反应 ②的化学方程式是 .
(3)操作a的名称是 .
(4)NH 4Cl可用作农业生产的氮肥,铵态氮肥常用 检验.
硫酸是化学实验室里的常见试剂.现利用质量分数为98%、密度为1.84g/cm 3的浓硫酸配制100mL质量分数为10%、密度为1.07g/cm 3的稀硫酸.(已知:水的密度近似为1g/cm 3,不同质量分数的溶液混合后总体积不是两种溶液体积之和)
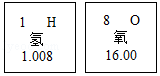
(1)量取浓硫酸时需要的仪器是 .
(2)配制该稀硫酸溶液时,下列方法最合理的是 (假设需要浓硫酸的体积是V mL).
a、分别用量筒量取V mL浓硫酸和(100﹣V)mL水,在烧杯中混合均匀
b、先量取V mL浓硫酸倒入烧杯中,再称量(107﹣1.84V)g水,慢慢倒入盛有浓硫酸的烧杯中混合均匀
c、先量取(107﹣1.84V)mL水倒入烧杯中,再将量取的V mL浓硫酸慢慢倒入盛水的烧杯中混合均匀
d、先在100mL量筒中加入V mL浓硫酸,然后向其中加水恰好至100mL刻度处混合均匀
(3)在量取浓硫酸时若俯视量筒的刻度线,则所配制的硫酸溶液的质量分数 10%(填"大
于"、"等于"或"小于").
(4)用pH试纸测定所配制的硫酸溶液的pH,正确的操作是 .
氢气是中学化学的重要试剂,可以与Fe 2O 3、CuO等多种金属氧化物反应得到金属单质.某化学兴趣小组利用白铁(表面镀锌的铁)加工业的下脚料制取氢气,生成的氢气与CuO反应,其反应装置如图:(部分夹持装置省略)
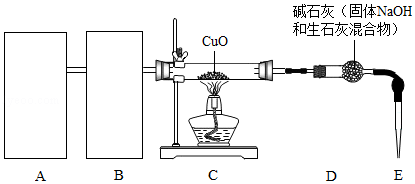
(1)从下图a、b、c中选择一套制取氢气的最佳装置 置于A处.
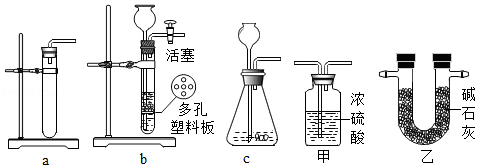
(2)该小组若选用盐酸和白铁片反应制取氢气,请为B处从上图甲和乙中选择一套合适的除杂装置 .
(3)检验装置气密性之后,点燃C处酒精灯之前必须进行的步骤是 .
(4)若称取CuO的质量为m 1g,反应一段时间后C处药品完全变为紫红色,此时停止加热,继续通入氢气至药品冷却,称量D装置,质量增加了m 2g,则m 1和m 2应满足的关系是 .(忽略其他因素带来的误差)
某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:
(1)如图所示甲同学记录天平砝码和游码的数据为54.0g.将气球中的10.0g铁粉样品加入到盛有过量的稀硫酸的锥形瓶中,反应停止后,天平是否平衡(不考虑空气浮力) (填"是"或"否");要想获取实验的相关数据,后面必须的操作是 (假设气球不破裂且能恢复原状).
| A. |
打开弹簧夹a放出气体 |
B. |
取下砝码 |
| C. |
向右拨动游码至天平平衡 |
D. |
向左拨动游码至天平平衡 |
(2)乙同学把10.0g铁粉样品加入到足量的硫酸铜溶液中,充分反应后过滤、洗涤、干燥、称量,得到固体10.8g,计算该样品中铁单质的百分含量.(写出计算过程)

 表示等体积、等质量分数的双氧水溶液分解,气体质量与时间的关系
表示等体积、等质量分数的双氧水溶液分解,气体质量与时间的关系 表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系
表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系 表示将饱和石灰水升温,溶液质量与温度的关系
表示将饱和石灰水升温,溶液质量与温度的关系 表示将足量二氧化碳通入澄清石灰水中,沉淀质量与通入量的关系
表示将足量二氧化碳通入澄清石灰水中,沉淀质量与通入量的关系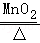 2KCl+3O 2↑
2KCl+3O 2↑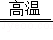 4Fe+3CO 2↑
4Fe+3CO 2↑ 加热KMnO 4制取O 2
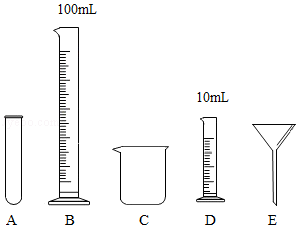
加热KMnO 4制取O 2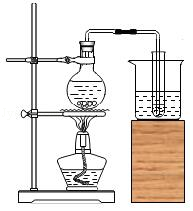 制取蒸馏水
制取蒸馏水 量取浓硫酸
量取浓硫酸 加热试管中液体
加热试管中液体 粤公网安备 44130202000953号
粤公网安备 44130202000953号