2017年湖南省永州市中考化学试卷
1滴水中大约有1.67×1021个水分子,这是因为( )
A.分子间有间隔
B.分子的质量和体积都很小
C.分子可分为原子
D.分子在不断地运动
化学在环境保护、资源核能源利用等方面起着重要的作用.下列说法不正确的是( )
A.涂油和刷油漆能防止钢铁生锈
B.使用可降解塑料可以减少“白色污染”
C.PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
D.目前计入空气污染指数的有害气体主要包括:SO2、CO、NO2、O2等
1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO)水溶液得到了尿素[CO(NH2)2],尿素[CO(NH2)2]属于( )
A.复合肥料B.氮肥C.磷肥D.钾肥
小唐同学对所需知识进行了归纳,其中叙述正确的是( )
A.KMnO4和MnO2都是氧化物
B.合金和合成材料都属于有机合成材料
C.过滤和蒸馏都能降低水的硬度
D.实验室收集O2和H2都可以使用排水法
为避免汽车尾气中的有害气体对大气的污染,目前最有效的方法是给汽车安装尾气净化装置,其净化原理是2NO+2CO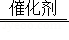 N2+xCO2,下列说法不正确的是( )
N2+xCO2,下列说法不正确的是( )
A.x=2
B.最终排放的汽车尾气是混合物
C.反应中氮元素的化合价由+2价变为0价
D.该反应生成的N2和CO2的质量比为1:2
如图为铜片A的系列变化,下列推断不正确的是( )

A.铜片表面上的黑色物质是CuO
B.方法1发生的反应类型是置换反应
C.方法2中现象为铜片上的黑色物质逐渐溶解,溶液变为蓝色
D.若方法1、方法2均完全反应,则铜片A、B、C的质量相等
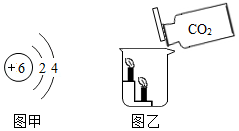
根据下列甲、乙图示和相关叙述,回答下列问题:
(1)图甲中该元素原子有 个电子层,最外层有 个电子.
(2)图乙所示的实验中,可以观察到 (选填“上层”或“下层”)蜡烛先熄灭,该实验都能得出CO2不能燃烧,也不支持燃烧,密度比空气 .
(3)最近,我国科学家宣布在南海成功开采可燃冰,成为世界上第一个能持续稳定开采可燃冰的国家,可燃冰外观像冰,它是在海底的高压、低温条件下形成的,它主要以甲烷水合物(CH4•8H2O)的形式存在,其中它的主要可燃成分是 (填化学式)
分析处理图表中的信息是学习化学的一种重要方法,如表是NH 4Cl和KNO 3在不同温度时的溶解度数据:
温度/℃ |
10 |
30 |
50 |
70 |
|
溶解度/g |
NH 4Cl |
33.3 |
41.4 |
50.4 |
55.2 |
KNO 3 |
20.9 |
45.8 |
85.5 |
110 |
|
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH 4Cl的溶解度为 g.
(2)NH 4Cl和KNO 3的溶解度受温度影响比较大的物质是 (填化学式).
(3)欲配制质量分数为10%的KNO 3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和 .
(4)烧杯中A中是60℃时,含有100g水的NH 4Cl不饱和溶液,经过如图1的变化过程
(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为 g 
(5)某同学欲验证NH 4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到 现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.
如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为 (填化学式),B瓶中澄清石灰水变浑浊,该反应的化学方程式为 。
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是 。
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO
②检验并吸收反应生成的CO2
上述说法中正确的
A.只有①B.只有②C.是①和②

某化学兴趣小组为探究复分解反应能否发生,进行了如下实验:
实验编号 |
① |
② |
③ |
物质 |
NaOH溶液 |
Na2CO3溶液 |
BaCl2溶液 |
加稀硫酸后的现象 |
无明显现象 |
|
白色沉淀 |
(1)实验②中的现象是 .
(2)小杨同学认为实验①不反应,小康同学不同意小杨同学的观点,认为无明显现象并不代表没有发生反应.
经小组讨论,设计如下实验来探究稀硫酸与NaOH溶液能否发生反应.

观察到上述实验试管中的现象 (选填“红色消失”或“红色不消失”),说明稀硫酸与NaOH溶液发生了反应,该反应的化学方程式为 .
(3)反应后,同学们将所有废液倒入同一烧杯中,静置,烧杯中有白色沉淀,溶液呈无色,该无色溶液中一定含有的溶质(除酚酞外)是 (填化学式)
某学习小组欲测定刚配制的BaCl2溶液中溶质的质量分数,采取下列两种方法:
方法1:取100gBaCl2溶液,加入适量的AgNO3溶液,两者恰好完全反应,并测得生成AgCl沉淀的质量为m1g;
方法2:取100gBaCl2溶液,加入m2g溶质的质量分数为a%的Na2SO4溶液,恰好使BaCl2溶液完全沉淀;
已知相关物质的相对分子质量:BaCl2=208 Na2SO4=142 AgCl=143.5
(1)请任选一种方法计算该BaCl2溶液中溶质的质量分数(写出详细的计算过程);
(2)如果采取上述两种方法,可推知a= (用含m1、m2的代数式表示)
 点燃酒精灯B.
点燃酒精灯B. 移走蒸发皿
移走蒸发皿 闻气味D.
闻气味D.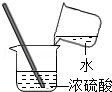 浓硫酸稀释
浓硫酸稀释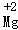
 多
多
 大
大 大
大 粤公网安备 44130202000953号
粤公网安备 44130202000953号