2016年吉林省长春市中考化学试卷
如图所示实验操作中,正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
下列说法中,错误的是( )
| A. |
氢气、石油都是储量丰富的清洁能源 |
| B. |
滥用化肥、农药会造成水体污染 |
| C. |
油脂、糖类都是人体所需的营养物质 |
| D. |
用灼烧法可区分羊毛和合成纤维 |
某物质X在空气中燃烧的化学方程式为:X+3O 2 2CO 2+2H 2O,下列说法正确的是( )
| A. |
X 的化学式是 C 2H 4 |
| B. |
该反应属于置换反应 |
| C. |
O 2中氧元素的化合价为﹣2 |
| D. |
CO 2中碳、氧元素的质量比为 1:2 |
下列对有关事实的解释,错误的是( )
| A. |
酒精需要密封保存﹣﹣酒精分子在不停运动 |
| B. |
冰水共存物属于纯净物﹣﹣冰和水都由水分子构成 |
| C. |
过氧化氢分解属于化学变化﹣﹣过氧化氢分子本身发生变化 |
| D. |
稀盐酸和稀硫酸都能使石蕊溶液变红﹣﹣两种溶液中都存在酸根离子 |
下列说法中,正确的是( )
| A. |
浓盐酸、浓硫酸都易挥发 |
B. |
CH 4、C 2H 5OH都能作燃料 |
| C. |
Al(OH) 3、NaOH都能治疗胃酸过多症 |
D. |
CO 2、SO 2都是有毒气体 |
下列说法中,错误的是( )
| A. |
加热挥发食盐水时未用玻璃棒搅拌,会导致局部过热液滴飞溅 |
| B. |
未打磨的铝片放入稀盐酸中,能立即观察到剧烈反应,产生大量气泡 |
| C. |
将 CO 2通入澄清石灰水中,未见浑浊,可能是CO 2中混有HCl气体 |
| D. |
将红热的木炭缓慢地插入盛有O 2的集气瓶中,能够充分利用瓶中O 2,有利于实验现象的观察 |
下列实验能达到相应目的是( )
| A. |
分离Zn和Cu的固体混合物:加适量的Cu(NO 3) 2溶液,过滤 |
| B. |
除去CaCl 2溶液中少量的HCl:加过量Ca(OH) 2固体,过滤 |
| C. |
验证BaSO 4中含有BaCO 3:取样,加适量稀盐酸,有气泡产生 |
| D. |
制备Cu(OH') 2:将CuSO 4溶液和适量Ba(OH) 2溶液混合,过滤 |
如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题。
(1)钠原子的最外层电子数为 ;
(2)构成氯化钠的粒子是 ;
(3)由原子核外电子层数与元素所在周期表中的周期数相同可知,氯元素在元素周期表中应排在第 周期。

回答下列与水有关的问题.
(1)利用 的吸附性去除水中的异味;
(2)生活中可通过 方法降低水的硬度;
(3)在电解水实验中, 极产生的气泡能够燃烧.
结合如图所示实验,回答有关问题。
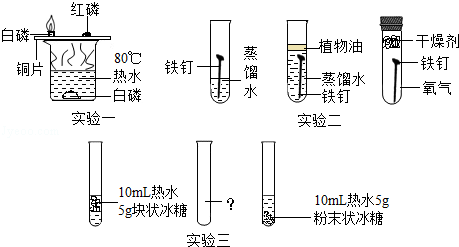
(1)实验一的目的是 ;
(2)实验二的结论:铁生锈是铁与 共同作用的结果;
(3)实验三,在B试管加入 (写出一种情况),即可证明温度和固体颗粒大小都是影响冰糖溶解快慢的因素。
回答下列与含碳物质有关的问题。
(1)天然存在的最硬的物质是 ;
(2)能将 CO 和 CO 2鉴别开的溶液是 ;
(3)K 2CO 3、Na 2CO 3、NaHCO 3都能与 (填具体物质)反应,生成CO 2。
根据如表数据,回答问题。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
KNO 3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
NaCl |
25.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
(1)20℃时KNO 3的溶解度是 g;
(2)60℃时,200gKNO 3溶液中含溶质 100g,将该溶液降温至 20℃,可析出KNO 3 g;
(3)NaCl溶液中含有少量KNO 3,提纯NaCl,采用的方法是 (选填"蒸发结晶"或"降温结晶")。
回答下列与金属有关的问题.
(1)铝合金和纯铝,硬度较大的是 ;
(2)工业上,把赤铁矿冶炼成铁的主要反应原理是 3CO+Fe2O3 2Fe+3CO2, 其中 发生了还原反应;
(3)比较Mn、Pd(钯)、Cu三种金属的活动性顺序
①将Mn片、Pd片分别加入到稀盐酸中,Mn片表面有气泡产生,Pd片没有变化.根据上述实验现象,得出的结论是 ;
②要确切得出这三种金属的活动性顺序,还需将Pd片加入到 溶液中,观察现象.
回答下列与配制溶液有关的问题.
(1)配置 50g 质量分数为 10%的NaCl溶液,需NaCl固体 g;
(2)用上述溶液配制 50g 质量分数为 5%的NaCl溶液,量取水时仰视读数,则所配溶液中溶质的质量分数 5%(选填“大于”、“小于”或“等于”);
(3)以上两个实验中,均用到的仪器有烧杯、滴管、量筒和 .
如图所示是实验室制取气体的常用仪器,回答下列问题。

(1)标号为e的仪器名称是 。
(2)用2KMnO 4 K 2MnO 4+MnO 2+O 2↑制取 O 2,并用向上排空气法收集。
①若制取3.2gO 2,理论上至少需要KMnO 4 g;
②检验O 2收集满的方法是 ;
(3)用大理石和稀盐酸反应制取CO 2,并用排空气法收集;
①该反应的化学方程式为 ;
②组装制取装置时,需选择上图中的a、b、h、i、j、m和 。
氧化铁是一种重要的化工原料,利用废铁屑(其中的杂质不溶于水,且不与酸发生反应)制备氧化铁的流程如图所示:
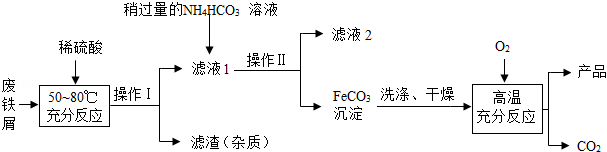
(1)操作Ⅰ、Ⅱ的名称是 ;
(2)向废铁屑中加入的稀硫酸需过量,其目的是 ;
(3)高温条件下,FeCO 3与通入的O 2发生反应的化学方程式是 。
如图所示,是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。

(1)A实验最终能观察到的现象是 ;
(2)B实验能体现出稀硫酸具有的化学性质是 ;
(3)C实验中发生反应的化学方程式为 ;
(4)将上述实验后所得溶液在烧杯中混合,观察到烧杯底部有沉淀,上层为有色溶液,此时,利用烧杯中的沉淀,再选择适当的试剂,即可证明C实验中所加BaCl 2溶液过量,实验的操作及现象是 。
 加热试管中的液体
加热试管中的液体 用橡胶塞塞住试管
用橡胶塞塞住试管 向试管中滴加液体
向试管中滴加液体 向试管中倾倒液体
向试管中倾倒液体
 粤公网安备 44130202000953号
粤公网安备 44130202000953号