2018年浙江省台州市中考化学试卷
如图为自来水生产过程示意图。下列说法正确的是( )

| A. |
清水池中的水是溶液 |
B. |
过滤池中主要发生化学变化 |
| C. |
消毒用的液氯是化合物 |
D. |
供水系统流出的水是纯净物 |
电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO 2)为原料制取,其中一步反应为:SiO 2+2C  Si+2CO↑.对该反应分析正确的是( )
Si+2CO↑.对该反应分析正确的是( )
| A. |
该反应属于置换反应 |
B. |
碳发生了还原反应 |
| C. |
碳元素化合价由0价变为+4价 |
D. |
该反应利用了CO的还原性 |
肝脏中含有过氧化氢酶。某同学利用动物肝脏研究酶的某些特点,实验记录如下表:
试管 |
实验材料及处理 |
产生气泡快慢 |
1 |
5毫升5%H 2O 2溶液+2滴蒸馏水,常温 |
最慢 |
2 |
5毫升5%H 2O 2溶液+2滴3.5%FeCl 3溶液,常温 |
较快 |
3 |
5毫升5%H 2O 2溶液+2滴肝脏研磨液,常温 |
最快 |
4 |
5毫升5%H 2O 2溶液+2滴肝脏研磨液,70℃水浴加热 |
较慢 |
分析实验结果,无法得出过氧化氢酶( )
| A. |
具有专一性 |
B. |
能加快过氧化氢分解 |
C. |
具有高效性 |
D. |
活性受温度影响 |
下列选项所示的物质转化均能一步实现的是( )
| A. |
Fe Fe 2O 3 Fe(OH) 3 |
B. |
CuO CuSO 4 CuCl 2 |
| C. |
|
D. |
CO 2 Na 2CO 3 NaOH |
某固体由Ba 2+、Cu 2+、Na +、Cl ﹣、CO 3 2 ﹣、SO 4 2 ﹣中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl 2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO 3溶液,产生白色沉淀。
则该固体中一定含有( )
| A. |
Na +、CO 3 2 ﹣、SO 4 2 ﹣ |
B. |
Cu 2+、CO 3 2 ﹣、SO 4 2 ﹣ |
| C. |
Cl ﹣、CO 3 2 ﹣、SO 4 2 ﹣ |
D. |
Na +、Ba 2+、Cl ﹣ |
图甲是一个"火山爆发"模型。将碳酸氢钠干粉和柠檬酸(C 6H 8O 7)干粉倒入火山模型内,火山模型内没有动静,慢慢注入水,两者就会剧烈反应(3NaHCO 3+C 6H 8O 7═C 6H 5O 7Na 3+3H 2O+3CO 2↑),"火山"就会爆发出来。
(1)自然界中的火山是 变动的表现。
(2)这个模拟实验为什么要加水呢?将碳酸氢钠干粉和柠檬酸干粉混合后,置于试管中(如图乙),立即伸入燃着的木条,火焰没有熄灭。用棉花封住管口,静置约半小时后再伸入燃着的木条,火焰熄灭。可见,水在本模拟实验中的作用是 。

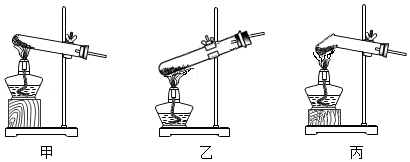
草酸固体熔点较低,受热熔化后,迅速分解生成水、一氧化碳和二氧化碳。
(1)草酸(H 2C 2O 4)中,氢、碳、氧原子的个数比为 。
(2)写出草酸受热分解的化学方程式: 。
(3)加热分解草酸固体,应选择图中的 装置。
19世纪初,电灯尚未发明,煤矿工人在矿井中只能借助煤油灯照明。矿井中通常存在大量的甲烷气体,遇火极易发生爆炸。1815年,化学家戴维设计出一种安全矿灯﹣﹣戴维灯(如图)。采用一种网眼很小的普通金属网罩住火焰,火焰只会在网中燃烧而不会引燃外界的甲烷气体。
(1)甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的 。
(2)用戴维灯照明,不会引燃矿井中的甲烷,原因是 。

活泼金属能将不活泼金属从其盐的水溶液中置换出来。与此类似,碳在高温下,能将不活泼金属从其氧化物中置换出来,但活泼金属形成的氧化物不与碳发生反应。如碳在高温下,能置换出氧化铁中的铁,但与氧化铝不反应。
(1)判断C、Fe、Al的活动性顺序由强到弱为 。
(2)结合所学知识,下列各组物质能发生置换反应的是
| A. |
碳与氧化铜 |
B. |
锌与稀硫酸 |
C. |
碳与氧化钙 |
D. |
银与硫酸铜 |
氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味。某兴趣小组利用浓氨水和浓盐酸探究分子运动速度与相对分子质量的关系。
方案Ⅰ:在两玻璃片上同时分别滴加少量相同体积的浓氨水和浓盐酸,将2张湿润的pH试纸分别置于距玻璃片上方15厘米处(如图甲),比较2张pH试纸变色的时间。
方案Ⅱ:将一支约35厘米长的玻璃管水平放置,将一湿润的pH试纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图乙),观察pH试纸的颜色变化。
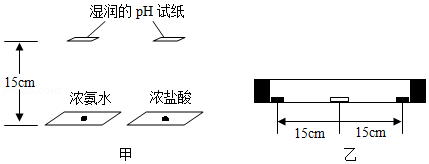
(1)方案I实验中,观察到两液滴间的上方出现白烟。针对此现象,你的合理猜想是 。
(2)请指出方案I的两点不足之处 。
(3)多次进行方案II的实验,均观察到试纸先变蓝色,得出相对分子质量越小分子运动速度越快的结论。为使该结论更具有普遍性,还应继续研究 。
镉是重金属污染中最受关注的元素之一。已有研究表明,秋华柳对镉具有较强的耐受和富集能力。为研究秋华柳受镉污染时,体内金属元素含量的变化。选取生长基本一致的幼苗,在不同镉离子浓度的土壤中进行分组实验。18天后测量植株各部分金属元素的含量,结果如图。
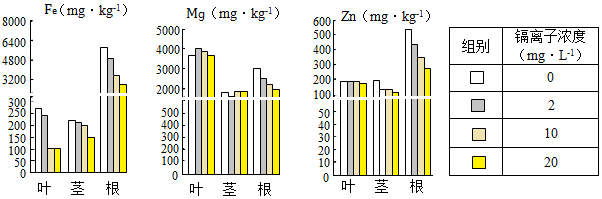
(1)由图可知,秋华柳叶片铁元素含量与镉离子浓度的关系是 。
(2)由实验结果可知,秋华柳 的变化可作为其受镉污染程度的指示。
(3)对镉污染土壤进行治理可采用化学沉淀法,即将土壤溶液中的镉离子形成沉淀物而降低污染。已知氯化镉易溶于水,碳酸镉和氢氧化镉难溶于水。下列物质可用于处理土壤镉污染的是 。
| A. |
氢氧化钠 |
B. |
氢氧化钙 |
C. |
碳酸钙 |
D. |
氯化钠 |
《中国居民膳食指南》建议成人平均每天食盐摄入量应在6克以下。据调查,我国成人平均每天食盐摄入量为10.5克。
(1)高盐饮食容易引发 。
| A. |
传染病 |
B. |
遗传病 |
C. |
心血管疾病 |
(2)人体摄入食盐后,主要在 被吸收进入血被循环。
(3)某品牌低钠盐含氯化钠70%,氯化钾30%。若某人每天摄入食盐6克,现以该低钠盐代替食盐,则每天可减少多少克钠元素的摄入?(结果精确到0.1)
某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
实验次数 |
1 |
2 |
3 |
碳酸钠质量/克 |
0.53 |
1.06 |
2.12 |
反应前装置总质量/克 |
66.33 |
66.86 |
67.92 |
反应后装置总质量/克 |
66.19 |
66.62 |
67.42 |
(1)计算第1次反应产生的二氧化碳质量。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号