2018年四川省攀枝花市中考化学试卷
我国化学家侯德榜创立的“侯氏制碱法”誉满全球,其中的“碱”指纯碱,也就是下列中的( )
A.氢氧化钠B.碳酸氢钠C.碳酸钠D.氯化钠
臭氧(O3)主要分布在距离地面10﹣25km的高空。它能吸收大部分紫外线,保护地球生物。臭氧属于( )
A.非金属单质B.金属单质C.化合物D.混合物
在果实膨大拉长期的芒果需要大量补充氮,钾等元素。下列符合条件的一种化肥是( )
A.KNO3B.Ca(H2PO4)2
C.NH4NO3D.(NH4)2H2PO4
运用灭火、自救等安全知识判断,下列做法不正确的是( )
A.炒菜时油锅着火,立即用锅盖盖灭
B.发现家中燃气泄漏,立即打开排气扇通风
C.电线老化短路起火,先切断电源,再用干粉灭火器灭火
D.逃离火灾现场时,可用湿毛巾捂住口鼻,并尽量贴近地面逃离
影视舞台上常利用干冰升华营造云雾燎绕的景象。下列关于干冰升华过程的说法正确的是( )
A.二氧化碳分子质量变小
B.二氧化碳分子的种类改变
C.二氧化碳分子间的间隔变大
D.二氧化碳分子体积变大
下列与水有关的说法中,不正确的是( )
A.少量白磷保存在冷水中
B.可用肥皂水区别软水和硬水
C.生活中常用煮沸的方法降低水的硬度
D.稀释浓硫酸时,一定要在浓硫酸中缓缓加入水
2018年5月21日我国成功发射“鹊桥”号中继卫星,卫星的星载天线金属网是用镀金铝丝编制的。钼、金元素信息如图,下列说法中不正确的是( )

A.金和钼都属于金属元素
B.金原子的质子数为79
C.金、钼原子的核外电子数相同
D.钼元素的相对原子质量为95.96
下列有关化学实验现象的描述错误的是( )
A.红磷在空气中燃烧产生大量白烟
B.铁丝在氧气中剧烈燃烧,火星四射,生成白色固体
C.对木炭和氧化铜的粉末加强热,固体由黑色变为红色
D.硫在氧气中燃烧,发出蓝紫色火焰。产生刺激性气味的气体
我国科学家采用一种新型复合催化剂,将煤气化产生的合成气直接转化为乙烯、丙烯等低碳烯烃。这项成果的微观示意图为:

下列说法正确的是( )
A.该反应属于置换反应
B.甲、丙、丁都是氧化物
C.反应前后分子种类、数目均不变
D.该反应的化学方程式为4CO+2H2 C2H4+2CO2
C2H4+2CO2
宋代著名的医学家宋慈编写的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理之一是:4Ag+2H2S+O2=2X(黑色)+2H2O下列说法中正确的是( )
A.X为Ag2S
B.金属活动性:Ag>Cu
C.反应中H2S和O2的质量比为17:16
D.反应前后,银元素、氧元素的化合价均没有改变
对于复分解反应,X+2NaOH═2Y+Cu(OH)2↓,下列分析中正确的是( )
A.X一定是CuCl2B.Y可能是H2O
C.相对分子质量大小:X>YD.Y可能是Na2SO4
30g某有机物M在氧气中完全燃烧,生成44gCO2和18gH2O,下列说法不正确的是( )
A.M含有C、H、O三种元素
B.M中氧元素的质量分数约为53.3%
C.完全燃烧时,M与消耗O2的质量比为15:16
D.3.0gM在2.4gO2氧气中燃烧生成2.4gCO、1.2CO2和1.8gH2O
混合物M由铁和氧化铜组成。取一定质量的M粉末放入足量稀硫酸中,充分反应后产生0.6g气体,并得到6.4g残留固体。则取用的M粉末质量为( )
A.24.8gB.30.4gC.36.0gD.41.6g
用化学用语填空:
(1)4个钠离子 。
(2)4个二氧化氮分子 。
(3)过氧化氢的化学式 。
(4)由8个硫原子构成的单质分子 。
有下列五种粒子的结构示意图

图中粒子共表示 种元素,表示稀有气体原子的是 (填编号),E粒子的化学符号为 ,A与C形成化合物的化学式为 。
硝酸钾、硝酸钠、氯化钾、氯化钠四种物质的溶解度曲线如图。
(1)由图可知:10℃时,溶解度最小的是 。
(2)若75g硝酸钠固体溶解在50g水中恰好得到饱和溶液,此时溶液温度为 (选填下列编号)。
A. 60℃ B. 70℃ C. 80℃ D. 90℃
(3)60℃时,若分别溶解相同质量的硝酸钾、硝酸钠、氯化钾、氯化钠恰好形成饱和溶液。则加入水最多的是 。
(4)固体M是由硝酸钾和氯化钾中的一种成二种组成。现取40gM加入50g50℃的热水(水温保持不变),固体完全溶解。对M的成分判断正确的是
(选填下列编号)
A.可能只有硝酸钾 B.可能只有氯化钾
C.可能是硝酸钾和氯化钾的混合物 D.一定是硝酸钾和氯化钾的混合物

锰及其化合物在生产中有重要作用。
(1)已知:MnSO 4+K 2MnO 4=2MnO 2↓+K 2SO 4
3MnSO 4+2KMnO 4+2H 2=5MnO 2↓+K 2SO 4+2H 2SO 4
则:①K 2MnO 4的名称是 。
上述化合物中,Mn元素化合价最高的是 。
②实验室加热高锰酸钾制取氧气后,将固体剩余物中的锰元素全部以MnO 2形式回收的方法是:将剩余物加入适量 溶液中,搅拌,充分反应后,过滤、洗涤、烘干即可。
(2)在高温下,Al与MnO 2发生置换反应可制备Mn.反应的化学方程式是 。
(3)锰锌铁氧体是一种隐形飞机表面涂料,其化学组成为 Mn xZn 1 ﹣ xFe 2O 4(铁为+3价)。
锰锌铁氧体中锰元素的化合价为 ,当锰锌铁氧体中Zn与Fe原子个数比为2:5时,它对某频段的雷达波吸收能力最强,其化学式为
能源和材料是推动社会发展的动力。
(1)可燃冰外观像冰,主要含有甲烷水合物,埋藏于海底的沉积物和陆地冻土的岩石中是未来新能源。由此分析:形成可燃冰的条件与 、压强有关。可燃冰在海底不燃烧的原因是 。
(2)将纯钢片与黄铜片相互刻划,在纯铜片上留下明显的划痕。该实验说明 。
(3)铝制品表面易形成致密氧化铝薄膜。氧化铝能溶于酸,氧化铝与稀硫酸反应的化学方程式是 。
CO 2能使润湿的蓝色石蕊试纸变红,原因是 (用化学方程式表示)。
若用如图装置证明:使蓝色石蕊试纸变红的物质是碳酸,不是水,也不是二氧化碳。有以下操作,应采取的操作顺序是 (填序号,其中①②③可重复使用)
①从b端通N 2
②打开分液漏斗活塞,向广口瓶中滴加适量水
③从a端通CO 2
④将干燥的蓝色石蕊试纸放入广口瓶中

无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产无水氯化钙的流程如图:

回答下列问题:
(1)从流程图中推知:SiO2具有的化学性质是 。
(2)加入BaCl2溶液的主要作用是 。
(3)滤渣3中除有Ca(OH)2外、还有 (填化学式)。
(4)产品中的杂质除极少量H2O外,最有可能含的是 (填化学式)。
CaH2(氢化钙)是野外作业常用的生氢剂。某实验小组查阅资料后设计如图装置制备CaH2.(夹持装置已略去)
已知:①在加热条件下,Ca与H2反应生成CaH2
②Ca、CaH2都易与水反应生成Ca(OH)2和H2
③碱石灰的主要成分是CaO和NaOH

回答下列问题:
(1)装置B中浓硫酸的作用是 。装置D中碱石灰的作用是 。
(2)实验步骤:先检验装置的气密性,装入药品后打开A中分液漏斗活塞,此后实验步骤的正确顺序是 (注:多余气体的处理不在本实验步骤中体现)。
①加热一段时间;
②在D出口处收集气体检验其纯度;
③关闭A中分液漏斗活塞;
④停止加热,充分冷却;
(3)制备实验结束后,有同学取出试管中的少量固体加入水,立即有大量气泡产生,固体溶解,向所得溶液中加入酚酞试液,溶液变为红色,该同学认为得到的固体全部是CaH 2.小组其他同学认为他的结论不一定正确,理由是 。
某小组同学利用pH传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。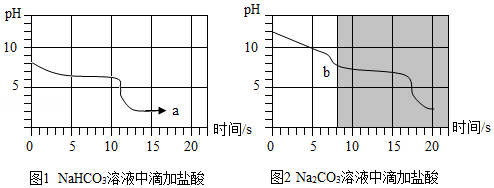
25℃时,向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,用pH传感器测得pH变化与时间的关系如图1、图2所示。将图1与图2的阴影部分进行叠加,发现两者基本重合。
回答下列问题:
(1)含等碳原子数的碳酸氢钠和碳酸钠溶液均呈碱性,两种溶液碱性较强的是 。
(2)a点的溶质为 ,b点前发生反应的化学方程式为 。
(3)依据实验获取的信息,请将鉴别Na2CO3和 NaHCO3固体的实验方案补充完整:分别取两种固体加入适量水溶解,逐滴缓缓加入稀盐酸, 。
Na 2S 2O 5(焦亚硫酸钠)、K 2S 2O 5(焦亚硫酸钾)等焦亚硫酸盐是常用的食品添加剂,现行国家食品安全标准规定:使用焦亚硫酸盐时,果酒中的残留量以SO 2计不得超过0.050g/kg。回答以下问题:
(1)Na 2S 2O 5的相对分子质量为 。
(2)若Na 2S 2O 5可改写为Na 2O•2SO 2,则K 2S 2O 5可改写为 。
(3)若制作果酒时使用了Na 2S 2O 5作添加剂,则合格的果酒中Na 2S 2O 5最大含量为 g/kg
 B.
B.
 D.
D.
 蒸发结晶B.
蒸发结晶B. 二氧化碳的验满
二氧化碳的验满 加热氯酸钾制氧气D.
加热氯酸钾制氧气D. 加热液体
加热液体
 粤公网安备 44130202000953号
粤公网安备 44130202000953号