河南省周口市高一下期期末调研考试化学试题
下列说法中正确的一组是 ( )
A.H2和D2互为同位素
B. 和
和 互为同分异构体
互为同分异构体
C.淀粉和纤维素互为同分异构体
D 和
和 是同一种物质
是同一种物质
下列各项中表达正确的是 ( )
| A.CO2的结构式:O—C—O | B.乙烯分子球棍模型:  |
C.NaCl的电子式: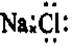 |
D.F- 的结构示意图: |
下列递变规律 正确的是 ( )
正确的是 ( )
| A.O、S、Na、K的原子半径依次增大 |
| B.Na、Mg、Al、Si的金属性逐渐增强 |
| C.HF、HCl、H2S、PH3的稳定性依次增强 |
D.KOH、Ca(OH )2、Mg(OH)2、Al(OH)3的碱性逐渐增强 )2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是 ( )
( )
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
| A.① | B.②③ | C.①③ | D.②④ |
苯分子中不存在单、双键交替排列的结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色 ②苯分子中碳原子之间的距离均相等③苯能在一定条件下跟H2加成生成环己烷④经实验测得邻二甲苯仅一种结构⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因化学变化而使溴水褪色 ( )
| A.①②③④ | B.①②④⑤ | C.①③④⑤ | D.②③④⑤ |
H2在Cl2中燃烧时产生苍白色火焰.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1KJ,断裂1molCl2中的化学键消耗的能量为Q2KJ,形成1molHCl中的化学键释放的能量为Q3KJ.下列关系式正确的是 ( )
| A.Q1+Q2>Q3 | B.Q1+Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+Q2<2Q3 |
下列化学反应属于取代反应的是( )
| A.乙烯与酸性高锰酸钾溶液的反应 | B.乙烯通入溴的四氯化碳溶液中的反应 |
| C.在浓硫酸作用下,苯在55℃左右与浓硝酸的反应 | |
| D.在镍作催化剂、加热的条件下苯与氢气的反应 |
对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是2v正(NH3)=3v正(H2O) |
下列关于乙烯和聚乙烯的叙述不正确的是( )
| A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B.乙烯的化学性质比聚乙烯活泼 |
| C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D.乙烯和聚乙烯都能使溴水褪色 |
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的三倍,下列说法正确的是( )
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,B极表面有大量气泡产生;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D经导线流向C;③A、C相连后,同时浸入稀H2SO4溶液中,H+向C极迁移;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺 序是 ( )
序是 ( )
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) 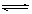 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和 H2O的总质量为27.6 g,其中H2O的质量为10.8 g,则CO的质量是( )
| A.1.4 g | B.2.2 g |
| C.4.4 g | D.在2.2 g和4.4 g之间 |
张清莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是( )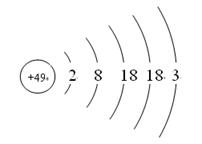
| A.In为长周期元素 |
| B.In为过渡元素 |
| C.In易导电导热 |
| D.In在反应中容易失电子 |
某有机物的结构简式如右图,该物质不应有的化学性质是( ) 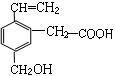
①可燃烧 ②可跟 溴加成; ③可使酸性KMnO4溶液褪色;
溴加成; ③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应;⑤可跟NaOH溶液反应;⑥可在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.⑥ |
现有乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为a,则碳的质量分数是( )
A.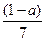 |
B. |
C.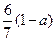 |
D. |
几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 |
K |
L |
M |
Q |
R |
T |
N |
| 原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
| 主要化合价 |
+1 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
下列叙述正确的是( )
A.K、L、M三种元素的金属性逐渐增加
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为  。
。
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示
回答下列问题:(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是 ,产生的现象为
(4)写出下列反应的反应类型:① ,④ 。
(5)写出下列反应的化学方程式:
① ;
② ;
③F与金属钠反应的化学方程式为
A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3 :4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为:
_____________________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:
_____________________________________________________________
糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为Ca(H2O)6,则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇【结构简式为:CH2 OH(CHOH)3CH2OH】是一种甜味剂,糖尿病人食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有 种同分异构体。
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60。
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3。
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入 溶液,发现有气泡冒出;
写出A与酒精反应的化学方程式 。
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质。下列说法正确的是 。
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。
(3)检查A装置的气密性的方法是用弹簧夹夹住 处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中 时,表明该装置不漏气 。
(4)装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________。
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
___________________________________________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号