广东省七校联合体高三上学期第二次联考理综化学试卷
下列说法错误的是
| A.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
| B.PM2.5表面积大,能吸附大量的有毒、有害物质 |
| C.高纯硅在太阳能电池及信息高速传输中有重要应用 |
| D.从海水中提取物质不一定要通过化学反应实现 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4LCl2完全溶于水时转移的电子数为NA |
| B.1 mol 羟基(-OH)含有的电子数为9NA |
| C.100g30%醋酸溶液中氢原子数为2NA |
| D.100mL水中OH-的个数是10-8NA |
下列离子反应方程式正确的是
| A.向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B.向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-=NH3·H2O |
| C.FeSO4溶液在空气中变黄色:4Fe2++O2+4H+=4Fe3++2H2O |
| D.用NaOH溶液吸收NO2气体:3NO2+2NaOH=2NaNO3+NO↑+H2O |
在下列条件下,一定能大量共存的微粒组是
| A.甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- |
| B.能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- |
| C.常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- |
| D.常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉·坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就。屠呦呦1971 年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命。青蒿素分子结构如右图。下列说法错误的是: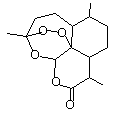
| A.青蒿素的分子式为C15H22O5 |
| B.青蒿素是芳香族化合物 |
| C.青蒿素可以发生水解反应 |
| D.青蒿素不能使酸性KMnO4溶液褪色 |
下列分离或提纯有机物的方法正确的是
| 选项 |
待提纯物质 |
杂质 |
除杂试剂及主要操作方法 |
| A |
乙烷 |
乙烯 |
酸性KMnO4溶液,洗气 |
| B |
MgCl2溶液 |
FeCl3 |
MgO,过滤 |
| C |
HCl气体 |
Cl2 |
饱和食盐水,洗气 |
| D |
乙醇 |
水 |
生石灰,过滤 |
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A.A、D两种元素形成的化合物中只含有极性键
B.A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性
C.原子半径由大到小的顺序是F>E>C>D
D.最高价氧化物对应水化物酸性最强的元素是C
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑,CH3CH2OH+HBr
NaHSO4+HBr↑,CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
| |
乙醇 |
溴乙烷 |
溴 |
| 状态 |
无色液体 |
无色液体 |
深红色液体 |
| 密度/(g·cm-3) |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
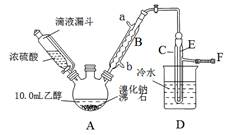
(1)A装置的名称是 。
(2)实验中用滴液漏斗代替分液漏斗的优点为 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式 。
(4)给A加热的目的是 ,F接橡皮管导入稀NaOH溶液,其目的主要是 。
(5)图中C中的导管E的末端须在水面以下,其目的是 。
(6)为了除去产品中的主要杂质,最好选择下列__(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的_____________(上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是______________。
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一, 其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型, 再采用硫酸酸解含铍矿物, 使铍、铝、铁等酸溶性金属进入溶液相, 与硅等脉石矿物初步分离, 然后将含铍溶液进行净化、除杂, 最终得到合格的氧化铍( 或氢氧化铍) 产品, 其工艺流程如右图。

已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是: ;
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是_____________________洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________,用平衡原理解释“除铁”的过程_____________________。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中, 石灰具有价格与环保优势, 焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3, 焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________,若纯碱加入过多则Al2O3、BeO也会发生反应,其中BeO与之反应的化学方程式是_______________________,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因_____________________。
某硫酸厂用以下几种方法处理SO2尾气。
(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。反应进行到不同时间测得各物质的浓度如图:
S2(g)+2CO2(g) 。反应进行到不同时间测得各物质的浓度如图:
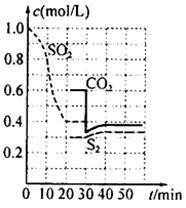
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ; 40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__________(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法

如右图所示,Pt(1)电极的反应式为 ;
碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣.则该硬水属于 (填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加 后加 。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式: 。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00mol•L﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为 。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
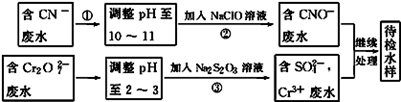
回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为 。
②含Cr3+废水需进一步处理,请你设计一个处理方案: 。
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。

(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___________,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:

醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: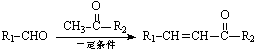 + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 。
(2)从A到B引入的官能团名称是 。
(3)反应②的化学方程式为 。
(4)反应③的化学方程式为 。
(5)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号