上海市松江区高三5月模拟测试化学试卷
2010年上海世博会的主题是“城市,让生活更美好”。大会提倡低碳、节能、环保,下列措施中不符合该主题的是
| A.世博园区公共交通使用的是纯电动汽车 |
| B.日本馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| C.为了方便游客园区发放一次性塑料袋 |
D.世博停车场安装催化光解设施,可将汽车尾气中 和NOx反应生成无毒气体 和NOx反应生成无毒气体 |
化学用语是学习化学的重要工具。以下化学用语表示错误的是
A.质量数之和是质子数之和两倍的水分子符号可能是: |
B.NaHCO3水溶液呈碱性的原因: |
C.硫离子的电子排布式: |
D.熔融状态下硫酸氢钠的电离方程式: (熔融)→ (熔融)→ |
下列实验过程中,无明显现象的是
A.NO2通入FeSO4溶 液中 液中 |
B.胆矾中加入浓硫酸 |
| C.HCl通入饱和NaCl溶液中 | D.CO2通入BaCl2溶液中 |
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
| A.CCl4中C—C1键键长比NC13中N—C1键键长短 |
| B.分子中的所有原子均达到8电子稳定结构 |
| C.NCl3分子是非极性分子 |
| D.NBr3比NCl3易挥发 |
定量实验是中学化学中的重要实验内容,下列定量实验选用实验仪器正确的是
| A.测定胆矾结晶水含量的实验需要用到的实验仪器之一为坩锅 |
| B.酸碱中和滴定可以任意选用酚酞、石蕊、甲基橙等常用指示剂 |
| C.配制一定物质的量浓度的盐酸溶液,需要的定量仪器只有量筒和容量瓶 |
| D.测定1摩尔气体体积的实验所需要的玻璃仪器有气体发生装置、储液瓶和液体量瓶。 |
某同学想用实验证明高锰酸钾的紫红色是MnO4-离子的颜色,而不是K+离子的颜色,他设计了以下实验方案。请你判断下列方案与本实验目的无关的是
| A.观察氯化钾溶液没有颜色,表明溶液中的K+离子无色 |
| B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| C.在高锰酸钾溶液中加入适量锌粉、振荡、静置后紫红色褪去,表明MnO4-为紫红色。 |
| D.将高锰酸钾晶体加热分解,所得的固体质量减轻 |
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是
| A.一定有SO32-离子 | B.不一定有CO32-离子 |
| C.不能确定Cl-离子是否存在 | D.不能确定HCO3-离子是否存在 |
用NA表示阿伏加德罗常数,下列说法中正确的是
①18g D2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含0.1NA个电子⑦1mol Na2O2与水完全反应时转移电子数为2NA
| A.③⑤⑥⑦ | B.③⑤ | C.①②④⑦ | D.③④⑤⑥ |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g)+197 kJ。实验测得起始、平衡时的有关数据如下表:
2SO3(g)+197 kJ。实验测得起始、平衡时的有关数据如下表:
| 容器[] |
起始各物质的物质的量/mol[来] |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
下列叙述正确的是
| A.Q1=Q2=Q3 |
| B.达到平衡时,丙容器中SO2的体积分数最大 |
| C.甲、乙、丙3个容器中反应的平衡常数相等 |
| D.若在上述条件下反应生成2molSO3(s)的反应放热小于197 kJ |
向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是
| A.水电离出的H+的浓度是1.0×10-4 mol·L-1 |
| B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3) |
关于下列各装置图的叙述中,错误的

|
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体C.装置③中X若为C6H6,可用于吸收NH3或HCl,并可防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
在复杂体系中,确认化学反应先后顺序有利于解决化学问题。已知溶液中阳离子氧化性顺序为:Ag+> Fe3+>Cu2+>H+> Fe2+>Na+,下列离子反应方程式错误的是
| A.2Ag++Fe →2 Ag + Fe2+ | B.2Fe3++ Cu → Cu2++ 2Fe2+ |
| C.2Fe3++3 Zn → 3Zn2++ 2Fe | D.Cu2++2 Na → Cu + 2Na+ |
下列说法正确的是
| A.溶液的PH值越小,表明溶液中含有的H+ 的数目越多 |
| B.由0.1 mol·L-1一元碱BOH溶液的pH = 10,可推知BOH溶液中存在关系BOH→B+ + OH- |
| C.0.1 mol·L-1的醋酸PH为a,0.01 mol·L-1的醋酸PH值为b,则a+1>b |
| D.已知酸性HF〉HAC,pH相等的NaF与 KAC溶液中,[c(Na+)-c(F-) < c(K+)-c(AC-)] |
把一块镁铝合金投入到1 mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图 A所示。下列说法中错误的是
A. 的取值范围为0≤a<50 的取值范围为0≤a<50 |
B. 的最大值为2.5 的最大值为2.5 |
| C.若将关系图改为B图时,则a的取值范围为80<a<90 |
D.若将关系图改为C图时,则 的取值范围为75<a<90 的取值范围为75<a<90 |
关于0.1mol/LNa2CO3溶液的叙述错误的是
| A.0.5L该溶液中钠离子的物质的量浓度为0.05mol/L |
| B.1L该溶液中含有Na2CO3的质量为10.6g |
| C.从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.01mol/L |
| D.取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L |
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体,③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸体现酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1mol NH4CuSO3完全反应转移0.5mol电子 |
| D.刺激性气味的气体是氨气 |
将氢氧化钠溶液滴入Ca(HCO3)2溶液中,可能发生反应的离子方程式为
| A.H+ + OH- →H2O |
| B.HCO3- + Ca2+ + OH- → CaCO3↓ + H2O |
| C.HCO3- + OH- → CO32- + H2O |
| D.2HCO3- + Ca2+ + 2OH- → CaCO3↓+ 2H2O + CO32- |
下列有关工业生产的叙述正确的是
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠。 |
| C.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体a L,将气体用足量的水吸收,剩余气体B的体积为a/6 L。下列相关推测正确的是
| A.NO2与O2的体积比为5:1 |
| B.气体B可能是NO2 |
| C.NO2与O2的体积比为2:1 |
| D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1 |
C和Si元素在化学中占有极其重要的地位。 (1)写出Si原子核外最外层电子排布式
(1)写出Si原子核外最外层电子排布式  。
。 C、Si和O元素的原子半径由小到大的顺序为 。
C、Si和O元素的原子半径由小到大的顺序为 。 (2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是 。SiC晶体熔点 晶体硅(填<、 >、=)。
(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是 。SiC晶体熔点 晶体硅(填<、 >、=)。 (3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显 性,相关的
(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显 性,相关的
离子方程式 。 (4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有 。(举一例说明)
(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有 。(举一例说明)
2011年3月,日本福岛核电站发生核泄漏,核泄漏的放射性物质中,大量存在一种叫做“碘-131”的放射性元素。传说吃含碘食品或服碘片可以减缓碘-131对人体的影响,有些人就去抢购碘盐、碘片。下表是某食用碘盐包装袋上的部分说明:
| 配 料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
| A.碘酸钾可氧化氯化钠 | B.只用淀粉就能检验碘盐中的碘酸钾 |
| C.高温会导致碘的损失 | D.该碘盐中碘酸钾含量约为34~84mg/kg |
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-→2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
① 2SO2(g)+O2(g) 2SO3(g)是 反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
2SO3(g)是 反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中 有着重要作用。
有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。
(热量Q的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是 (用离子方程式表示) 。
(用离子方程式表示) 。
(25°C时AgCl和AgI的离子积常数KSP为:
KSP[AgCl]=1.0×10-10 mol2·L-2 , KSP[AgI]=1.5×10-16 mol2·L-2 )
为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
(1)怎样检验装置的气密性 ;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为 ;写出
B中发生反应的离子方程式 。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是 。
(4)D的作用是_______________。烧杯中加入的是 。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用 药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用 药品替代。
工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果。实现了废水处理过程的“三废”零排放。其主要工艺流程如下:
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为 ,通过与石灰发生 反应(填基本反应 类型)被吸收。
类型)被吸收。
(2)写出一级沉砷过程中生成雌黄的离子方程式: 。
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质 。
(4)二级沉砷过程中使用双氧水的目的有 。
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:
(6)滤渣B的主要成分有 (写两种,用化学式表示)。
碳、氢、氧元素的质量比为6∶1∶8的有机物A、B、C、,它们都能发生银镜反应,但都不能发生水解反应。B1、B2是B的同分异构体。又知:
A在常温下为气体,A+C6H5OH Z(高分子化合物)
Z(高分子化合物)
B1易凝为冰状晶体:B1+Na2CO3 X+CO2+H2O;X+NaOH
X+CO2+H2O;X+NaOH  Y(最简单的烃)
Y(最简单的烃)
B2为无色液体,也能发生银镜反应。1 mol C完全燃烧需要3 mol氧气。
−CH(OH)2 或 −C(OH)2− 不稳定,易脱水形成−CH=O或 −CO−。试回答:
(1)A→Z的反应类型
(2)A、B的结构简式:A 、B ;
(3)写出B2与氢氧化钠反应的化学方程式: ;
(4)C的结构简式 ,与C互为同分异构体 ,且属于乙酸酯类化合物
,且属于乙酸酯类化合物
的结构简式 , 。
已知:RCN RCOOH。毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下:
RCOOH。毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下:
试回答下列问题:
(1)在吡氟氯禾灵的合成所涉及的反应中,属于加成反应的有 (填序号)。
(2)B的结构简式为 。
(3)1 mol C分子最多可与 mol NaOH 完全反应。
(4)写出下列反应的化学方程式:
反应⑥ ;
A发生缩聚反应 。
(5) 的含有三氟甲基(F3C一)和苯环的同分异构体共有 种。
的含有三氟甲基(F3C一)和苯环的同分异构体共有 种。
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 |
10℃ |
40℃ |
75℃ |
| 未溶固体 |
261 g |
175 g |
82 g |
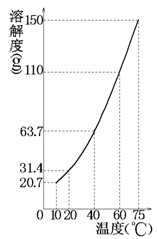
通过计算回答:
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)在什么温度将mg硝酸钾溶于ng水中恰好达到饱和状态?
 混合物投入足量水中,充分反应后生成Ymol沉淀
混合物投入足量水中,充分反应后生成Ymol沉淀
 粤公网安备 44130202000953号
粤公网安备 44130202000953号