江苏省如皋市五校高二下学期期中调研化学试卷
下列有关表述正确的是
| A.—OH与OH-组成元素相同,含有的质子数也相同 |
B.NH4Cl的电子式为: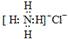 |
C.丙烷分子的比例模型示意图: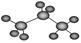 |
D.CO2分子的比例模型示意图: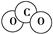 |
短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
| A.X与Y不可能位于同一主族 | B.X与Y一定位于同一周期 |
| C.X与Y不可能形成共价化合物XY | D.X与Y可能形成离子化合物XY |
下列各组物质的晶体中,化学键类型、分子极性及晶体类型均相同的是
| A.SO2和SiO2 | B.CO2和CH4 | C.NaCl和HCl | D.CCl4和H2O2 |
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示。顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是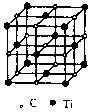
| A.TiC | B.Ti6C7 | C.Ti14C13 | D.Ti13C14 |
下列说法中错误的是
| A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 |
| B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 |
| C.非金属单质只能形成分子晶体 |
D.短周期元素离子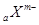 和 和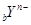 具有相同的电子层结构,若 具有相同的电子层结构,若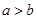 ,则 ,则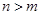 |
下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小: NaF> NaCl> NaBr>NaI |
下列各组无色溶液的离子组在pH=l时能大量共存的是
| A.NH4+、C1-、Mg2+、SO42- | B.A13+、Cu2+、SO42-、C1- |
| C.Ba2+、K+、NO3-、OH- | D.Ca2+、Na+、C1-、A1O2- |
氢叠氮酸(HN3)与醋酸性质相近,其盐稳定,但受撞击时易迅速发生反应,生成氮气。关于氢叠氮酸以下说法:①NaN3的水溶液呈碱性 ②固体HN3属分子晶体 ③固体NaN3属离子化合物 ④NaN3可用于小汽车防撞保护气囊,其中正确 的是
的是
| A.①②③ | B.①②③④ | C.②③④ | D.①③④ |
下列文字表述与反应方程式对应且正确的是
| A.过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑ |
| B.含等物质的量的KHCO3和Ba(OH)2溶液混合: HCO+Ba2++OH-===BaCO3↓+H2O |
| C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O |
D.硫化钠水溶液呈碱性:S2-+H2O HS-+OH- HS-+OH- |
下列说法正确的事(NA为阿伏伽德罗常数)
| A.12g石墨中含有C-C键的个数为1.5NA |
| B.60g SiO2中含有Si-O键的个数为2NA |
| C.18g冰中最多含有4 NA个氢键 |
| D.标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
下列说法正确的是:

A.电子从3S能级跃迁到3P能级形成的光谱是发射光谱 |
B.白磷(P4)分子是正四面体结构,故分子中的键角为1090281 |
C.NO2-中心原子采取sp2杂化,分子空间构型为“V”形 |
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
下列数据是对应物质的熔点,有关的判断错误的是
| Na2O |
Na |
AlF3 |
AlCl3 |
Al2O3 |
BCl3 |
CO2 |
SiO2 |
||||
| 920℃ |
97.8℃ |
1291℃ |
190℃ |
2073℃ |
-107℃ |
-57℃ |
1723℃
|
下列说法正确的是
| A.元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行 |
| B.X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
| C.Li是最活泼金属,F是最活泼非金属 |
| D.NaOH碱性比KOH强 |
下列有关数据的比较,不正确的是
A.元素的价电子数和所在族的族 序数相等 序数相等 |
| B.NaOH晶体中的阳离子和阴离子数目相等 |
| C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 |
| D.[Co(NH3)6]3+中的NH3分子数与配位键数相等 |
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
⑴白色沉淀A加试剂②反应的离子方程式是__________________________________。
⑵无色溶液C加试剂③的主要目的是____________ ________________________。
________________________。
⑶白色沉淀A若加试剂③而不加试剂②,对实验的影响是_______________________。
⑷气体E通入试剂④发生反应的离子方程式是__________________________________。
下表是元素 周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 一 |
① |
|
|||||
| 二 |
|
|
|
② |
③ |
④ |
|
| 三 |
⑤ |
|
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
⑴ ④⑤⑥的原子半径由大到小的顺序为
⑵ ②③⑦的最高价含氧酸的酸性由强到弱的顺序为
⑶ ⑦⑧⑨的第一电离能由小到大的顺序为
⑷比较④和⑨的氢化物的稳定性大小  ,沸点高低
,沸点高低
⑸写出元素⑩的 +1价含氧酸的结构式
+1价含氧酸的结构式
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。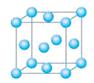
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键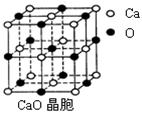
⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
⑴第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
⑵第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
⑶用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
⑷Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(6)①HClO4、②HIO4、③H5IO6 [可写成(HO)5IO] 的酸性由强到弱的顺序为 (填序号)。
高温超导材料是科学家研究的重点物质之一。
⑴科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下左图所示。该富勒烯化合物中的化学式为 。
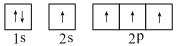
⑵某同学画出的C的基态原子核外电子轨道表示式(如上右图),该电子排布图违背了 。
⑶金属钾采用的是下列 (填字母代号)堆积方式,每个钾原子的配位数是 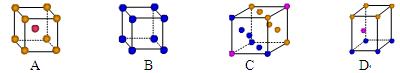
⑷富勒烯(C60)的结构如图。
①1 mol C60分子中σ键的数目为 。
②已知:金刚石中的C-C的键长为154.45 pm,C60中C-C键长为145~140 pm。有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由: 。
零排放、太阳能、绿色光源等高科技点亮2010上海世博。
⑴世博园区外围设置生态化停车场,有害尾气被纳米光触媒涂料分解为无毒物质,汽车尾气中的下列物质属于由极性键形成的非极性分子的是 。
a.CO b.NO c.NO2 d.CO2
⑵“一轴四馆”中安装了高亮度节能的陶瓷金卤灯,金卤灯中填充物通常包含Na、81Tl、49In、Sc、I等元素的单质或化合物。有关说法正确的是 。
a.第ⅢA元素铊和铟,第一电离能Tl小于In
b.元素Sc位于周期表s区
c.钠的熔点低,是因为金属键较弱
d.碘的电负性大于氯
⑶世博锗广泛采用了冰蓄冷空调。冰蓄冷空调采用液态化合物乙二醇(HOCH2CH2OH)介质,乙二醇沸点高, 是由于 。
是由于 。
⑷上海城区大规模集中使用“2l世纪绿色光源”LED半导体照明,LED晶片采厢砷化镓(GaAs)等材料组成。其中Ga 原子在基态时,其价电子轨道表示式为: 。GaAs的晶胞结构如图(As位于顶点和面心),晶胞中与As原子等距离且最近的Ga原子有 个。
原子在基态时,其价电子轨道表示式为: 。GaAs的晶胞结构如图(As位于顶点和面心),晶胞中与As原子等距离且最近的Ga原子有 个。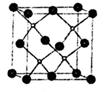
⑸“东方之冠”(中国馆)表面装有7000多块红色铝板,红色铝板为新型氟碳喷涂型材,一种氟碳涂层聚脂(FEP),它的单体为CF3-CF=CF2,该分子中碳原子的杂化方式有: 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号