[北京]2011届北京市西城区高三上学期期末考试化学试卷
下列说法不正确的是
| A.维生素是参与生物生长发育和新陈代谢所必需的一类有机化合物 |
| B.糖类、油脂、蛋白质、维生素、无机盐和水是人体所需的营养素 |
| C.阿司匹林是一种人工合成药物,具有解热镇痛等作用 |
| D.合成纤维和光导纤维都是新型的无机非金属材料 |
下列物质中,既含有离子键又含有极性共价键的是
| A.Na2O2 | B.MgCl2 | C.HCl | D.NH4Cl |
下列顺序表述正确的是
| A.酸性:H3PO4> HNO3> HClO4 | B.稳定性:H2O > HF > H2S |
| C.原子半径:Na > Mg > O | D.还原性:F-> Cl-> S2- |
下列现象与电化学腐蚀无关的是
| A.生铁比纯铁易生锈 | B.纯银饰品久置表面变暗 |
| C.黄铜(铜锌合金)制品不易产生铜绿 | D.与铜管连接的铁管易生锈 |
下列说法正确的是
| A.少量金属Na应保存在水中 |
| B.用萃取的方法可除去水中的Cl-离子 |
| C.Na2SiO3溶液应保存在带玻璃塞的试剂瓶中 |
| D.用向沸水中滴加FeCl3饱和溶液的方法可制Fe(OH)3胶体 |
实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是
| A.NaNO2是还原剂 |
| B.NH4Cl中N元素被还原 |
| C.生成1 mol N2时转移6 mol 电子 |
| D.氧化剂和还原剂的物质的量之比是1︰1 |
下列说法正确的是
| A.若发生A2+ 2D-=2A-+D2反应,则氧化性D2>A2 |
B.若X原子的质子数是a,中子数是b,则该核素可表示为 X X |
| C.若相同温度和浓度的两种钠盐溶液的碱性NaA<NaB,则酸性HA>HB |
| D.若主族元素的简单离子R 2-和M+的电子层结构相同,则原子序数R>M |
下列实验操作正确的是
| A.用饱和溴水除去甲苯中混有的苯酚 |
| B.用氨水洗涤除去试管内壁上的银镜 |
| C.实验室用加热NH4Cl固体使之分解的方法制NH3 |
| D.用稀硫酸和Zn反应制H2时,加少量CuSO4溶液可加快反应速率 |
已知:乙醇可被强氧化剂氧化为乙酸。  可经三步反应制取
可经三步反应制取 ,发生反应的类型依次是
,发生反应的类型依次是
| A.水解反应、加成反应、氧化反应 | B.加成反应、水解反应、氧化反应 |
| C.水解反应、氧化反应、加成反应 | D.加成反应、氧化反应、水解反应 |
在下列溶液中,一定能大量共存的一组离子是
A.溶液的pH=13:ClO-、HCO 、Na+、Mg2+ 、Na+、Mg2+ |
B.溶液中含有大量NO :NH4+、I-、SO :NH4+、I-、SO 、H+ 、H+ |
C.溶液中c(HCO )=0.1 mol/L:Na+、K+、CO )=0.1 mol/L:Na+、K+、CO 、Br- 、Br- |
| D.溶液中由水电离出的c(H+)=1×10-13mol/L:Na+、H+、Cl-、Br- |
将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;
③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
| A.④③②① | B.②③④① | C.①④③② | D.①③②④ |
NA表示阿伏加德罗常数。下列说法正确的是
| A.7.8 g Na2O2中含有的阴离子数目为0.2 NA |
| B.标准状况下,2.24 L CHCl3的分子数为0.1 NA |
| C.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA |
| D.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2 NA |
某原电池装置如图所示。下列有关叙述中,正确的是
| A.Fe作正极,发生氧化反应 |
| B.负极反应: 2H+ + 2e-=H2↑ |
| C.工作一段时间后,两烧杯中溶液pH均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al + 2OH-=2AlO + H2↑ + H2↑ |
| B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2↑+ H2O |
| C.氯气通入NaOH稀溶液中:Cl2 + 2OH-= Cl-+ ClO-+ H2O |
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H++ SO + Ba2+ +OH-= BaSO4↓+ H2O + Ba2+ +OH-= BaSO4↓+ H2O |
已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
| A.溶液的质量 | B.Ca(OH)2的溶解度 |
| C.溶液中Ca2+离子的数目 | D.溶液中溶质的质量分数 |
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g)  2C(g)ΔH<0。
2C(g)ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;
④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号) 。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是 。
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,CO的平衡转化率为 。
现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。
(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=13,则R在周
期表中的位置是 ,X中阴离子的电子式是 ,B转化为C的离子方程式是 。
(2)若常温下A、B、C、X均为气态物质,1 mol A中含有共价键的数目约为1.806×1024, X为单质,A与X反应生成B的化学方程式是 ;在一定条件下,
A可与C反应消除C对大气的污染,该反应的化学方程式是 。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水反应的离子方程式是 。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。
则反应前的溶液中与反应后的滤液中水电离出的c(OH—)的比值是 。
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知碳酸的酸性强于次氯酸)。
兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| I |
稀硫酸中加入铜片 |
无明显变化 |
| II |
硝酸钠溶液中加入铜片 |
无明显变化 |
| III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是 。
②实验III中反应的本质是(用离子方程式表示) 。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
① Cu作 极。 ②总反应的离子方程式是 。
有关FeSO4的转化关系如下图所示(无关物质已略去)。
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应I的反应类型属于(填序号) 。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是 。
某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):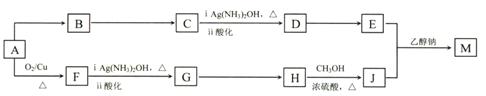
已知:① E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1。
②
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是 。(2)D→E反应的化学方程式是 。
(3)A→B反应所需的试剂是 。
(4)已知1 mol E 与2 mol J 反应生成1 mol M,则M的结构简式是 。
(5)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有 种,其中任意一种的结构简式是
(6)J 可合成高分子化合物,该高分子化合物结构简式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号