浙江省温州市高三五校联考化学试卷
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)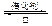 2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题: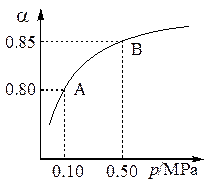
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_______ ______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示: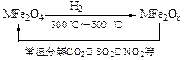
请写出MFe2Ox分解SO2的化学方程式______________________________________(可不配平)。
大气中二氧化碳、甲烷和其他造成“温室效应”的气体大量排放,已使全球环境受到严重破坏。控制二氧化碳排放,需要从人人做起,“低碳生活”成为新的时尚潮流。下列不属于“低碳生活”方式的是 ( )
A.多用电子邮件、MSN、 QQ等即时通讯工具,少用传真打印机 QQ等即时通讯工具,少用传真打印机 |
| B.尽量使用太阳能等代替化石燃料 |
| C.减少使用一次性餐具 |
| D.提倡塑料袋的无偿使用 |
下列事实与氢键有关的是
( )
| A.水加热到很高的温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
某温度下,反应N2O4(g)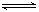 2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正( )
2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正( )
| A.加压时(体积变小),将使正反应速率增大 |
| B.保持体积不变,升高温度,再达平衡时颜色变深 |
| C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 |
| D.保持体积不变,加入少许NO2,将使正反应速率减小 |
下列实验能达到预期目的的是 ( )
| A.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
C.称取19.0 g SnCl2,用100  mL蒸馏水溶解,配制1.0 mol·L-1SnCl2溶液 mL蒸馏水溶解,配制1.0 mol·L-1SnCl2溶液 |
| D.用氢氧化铜粉末检测尿糖 |
下列 离子方程式正确的是
离子方程式正确的是
( )
A.硫化钠的水解反应:S2-+H3O+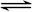 HS-+H2O HS-+H2O |
| B.在氯化亚铁溶液中加入稀硝酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O |
| C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液: Ca2++HCO3-+OH-=CaCO3↓ + H2O |
D.用铜为电极电解稀硫酸溶液: 2H2O  O2↑ + 2H2 ↑ O2↑ + 2H2 ↑ |
设NA表示阿伏加德罗常数的值,下列说法正确的是  ( )
( )
| A.2.4g镁在二氧化碳中燃烧所转移的电子总数为0.2NA |
| B.7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2 NA |
| C.1 L1 mol/L的Na2CO3(aq)中CO32-与HCO3-的离子数之和为NA |
| D.1 mol NaHSO4晶体中离子总数为3NA |
下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤使pH试纸变为蓝色的溶液:Na+、C1-、S2-、ClO- ⑥无色溶液中:K+、Al3+、NO3-、HCO3-
| A.①②⑤ | B.③⑤⑥ | C.②④ | D.②④⑥ |
工业上常用氨碱法制取纯碱,是将氨和二氧化碳先后通 入饱和食盐水而析出小苏打,再经过滤,焙烧而得纯碱。但不能用氨碱法制取
入饱和食盐水而析出小苏打,再经过滤,焙烧而得纯碱。但不能用氨碱法制取 碳酸钾,原因可能是 ( )
碳酸钾,原因可能是 ( )
| A.KHCO3溶解度较大 | B.KHCO3溶解度较小 |
| C.K2CO3溶解度较小 | D.K2CO3溶解度较大 |
高温下,某反应达平衡,平衡常数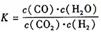 恒容时,温度升高H2浓度减小。下列说法正确的是 ( )
恒容时,温度升高H2浓度减小。下列说法正确的是 ( )
| A.该反应化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) |
B.恒温恒容下,增大压强 ,H2浓度一定减小 ,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应的焓变为正值 |
单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化钛制金属钛, 主要反应有:
①FeTi03+3H2SO4=Ti(SO4)2+FeSO4+3H2O ②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3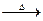 TiO2+H2O ④TiO2+2C+2Cl2
TiO2+H2O ④TiO2+2C+2Cl2 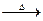 TiCl4↑+CO↑
TiCl4↑+CO↑
⑤TiCl4+2Mg 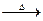 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是 ( )
| A.反应①属于非氧化还原反应 |
| B.反应②是水解反应 |
| C.反应④中二氧化钛是氧化剂 |
| D.反应⑤表现了金属镁还原性比金属钛强 |
绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是 ( )
| A.分子中所有的碳原子均可能在同一平面内 |
| B.1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 |
| C.1mol绿原酸与足量NaOH溶液反应,最多消耗4mol NaOH |
| D.绿原酸水解产物均可以与FeCl3溶液发生显色反应 |
下列液体均处于25℃ ,有关叙述正确的是
( )
| A.某物质的溶液pH < 7,则该物质一定 是酸或强酸弱碱盐 |
| B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-) |
以下物质间的每步转化,不能通过一步反应实现的是 ( )
| A.S→SO2→H2SO4→MgSO4 | B.Al→Al2O3→Al(OH)3→NaAlO2 |
| C.Fe→FeCl2→Fe(OH)2→Fe(OH)3 | D.N2→NO→NO2→HNO3 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
( )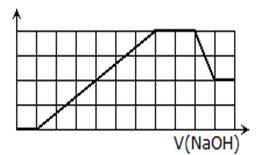

| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O O 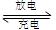 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被还原 |
| D.放电时正极附近溶液的碱性减弱 |
某温度时,AgCl (s)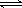 Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 ( )
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 ( )
| A.加入AgNO3可以使溶液由c点变到d点 |
| B.加入固体NaCl则AgCl的溶解度减小,Ksp也减小 |
| C.d点有AgCl沉淀生成 |
| D.c点对应的Ksp小于a点对应的Ksp |
一定量的Fe和Fe2O3混合物投入2 mol/L 250ml的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
| A.450ml | B.500ml | C.400ml | D.无法确定 |
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单 质与物质甲发生的反应 。
质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是 :
:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ②  ③ 。
③ 。
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(已知:4H++2 [Ag(S2O3)2]3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
⑴操作Ⅲ的名称是 ;操作Ⅱ需要的主要玻璃仪器有 。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是  。
。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 。
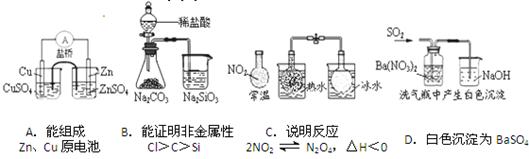
 (苯胺,易被氧化)。甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物。以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下。
(苯胺,易被氧化)。甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物。以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下。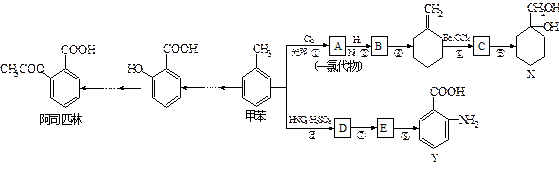 请回答下列问题:
请回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号