湖北省孝感高中高二下学期期末考试化学试题
下列关于有机化合物的叙述中,错误的是
| A.糖的甜度:果糖>蔗糖>葡萄糖 |
| B.煤中含有苯 |
| C.蛋白质溶液可发生丁达尔现象 |
| D.石油中含有烷烃、环烷烃和芳香烃 |
在通常条件下,下列各组物质的性质排列正确的是
| A.熔点:CO2>KCl>SiO2 | B.水溶性:HCl>H2S>SO2 |
| C.沸点:乙烷>戊烷>丁烷 | D.热稳定性:HF>H2O>NH3 |
 在测定硫酸铜晶体结晶水含量的实验中,下列操作会引起测量结果偏小的是( )
在测定硫酸铜晶体结晶水含量的实验中,下列操作会引起测量结果偏小的是( )
| A.加热前称量时坩埚未完全干燥 | B.加热时间过长,晶体部分变黑 |
| C.加热过程中有少量晶体溅出 | D.粉末未完全变白就停止加热 |
下列推断合理的是
| A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,Al(OH)3胶体呈电中性 |
| B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
| D.将SO2通入品红溶液,溶液褪色后加热能恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
下列关于晶体的说法正确的组合是
①分子晶体常温下都呈液态或气态 ②在晶体中只要有阴离子就一定有阳离子 ③金刚石、SiO2、NaF、NaCl、H2O晶体的熔点依次降低 ④分子晶体中只有共价键没有离子键,离子晶体中只有离子键没有共价键 ⑤氯化铯晶体中每个离子周围均吸引着6个带相反电荷的离子 ⑥原子晶体中的各相邻原子都以共价键相结合 ⑦分子晶体中分子间作用力越大,分子越稳定 ⑧氯化钠熔化时离子键被破坏
| A.②③⑥⑧ | B.①②③⑧ |
| C.③⑤⑥⑦ | D.③⑤⑥⑧ |
下列各组离子能在指定溶液中,可能大量共存的是( )
①无色溶液中:K+、Na+、CO32—、SO42—
②pH=11的溶液中:Na+、Ba2+、AlO2—、ClO—
③水电离出的c(H+) =10—12mol·L—1的溶液中:Mg2+、NH4+、HCO3—、S2—
④加入Al放出H2的溶液中:Cu2+、NH4+、Cl—、NO3—
⑤无色溶液中:K+、Na+、 、
、
⑥酸性溶液中:Fe2+、Al3+、NO3—、Cl—
| A.①②④ | B.①②④⑥ | C.①② | D.①②⑤ |
根据相关化学原理,下列判断正确的是( )
A.若X是原子晶体,Y是分子晶体,则熔点:X>Y
B.若 ═
═ ,则氧化性:D2>A2
,则氧化性:D2>A2
C.若 和
和 的电子层结构相同,则原子序数:R<M,离子半径:
的电子层结构相同,则原子序数:R<M,离子半径:
D.若弱酸HA、HB的酸性HA>HB,则溶液的碱性NaA>NaB
下列离子方程式书写正确的是
| A.溴乙烷与6mol/L的氢氧化钠水溶液共热: C2H5Br+OH-  CH2=CH2↑+Br-+H2O CH2=CH2↑+Br-+H2O |
| B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合: Ca2++2HCO3-+2OH-  CaCO3↓+CO32-+2H2O CaCO3↓+CO32-+2H2O |
| C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸: 3Fe2++4H++NO3-  3Fe3++NO↑+2H2O 3Fe3++NO↑+2H2O |
D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2 2Mn2++5O2↑+8H2O 2Mn2++5O2↑+8H2O |
下列各项实验操作正确的是
| A.使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B.为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C.将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D.在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.1mol H2O2中含极性共价键数为NA,含非极性共价键数为2NA |
| B.1mol固体Na218O2与足量CO2反应后,固体质量增重28g |
| C.S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA |
| D.60gSiO2中含Si—O键的个数为2 NA |
把晶体丙氨酸溶于水,加入NaOH使溶液呈现强碱性,则下列四种微粒中,存在最多的是

A. |
B. |
C. |
D. |
“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法正确的是
| A.它的分子式是C11H15NO2 |
| B.从有机物分类看,它可属于“氨基酸类”、“酯类”、“芳香烃类” |
| C.它能与盐酸反应,但不能与苛性钠溶液反应 |
| D.甲酸丁酯基(-COOC4H9)只有三种不同结构 |
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是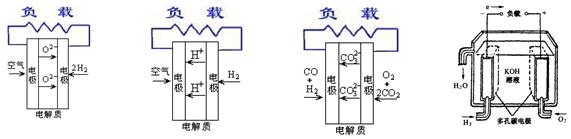
| A.固体氧化物燃料电池 | B.质子交换膜燃料电池 | C.熔融盐燃料电池 | D.碱性燃料电池 |
已知298K时,N2(g)+3H2(g) 2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是



| A.Q1 = Q2 =" 92.4kJ" | B.Q2 < Q1 = 92.4kJ |
| C.Q2< Q1<92.4kJ | D.Q2 = Q1< 92.4Kj |
以下是分离乙酸乙酯、乙酸、乙醇的混合物的流程图,图中圆括号内填入适当的试剂,方括号内填入适当的分离方法,方框内是有关物质的名称。下列说法正确的是( )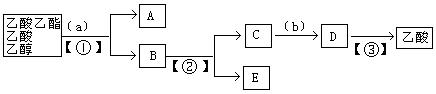
| A.a为NaOH溶液,①为蒸馏 | B.②、③均为蒸馏,①为分液 |
| C.②为分液,C中含有醋酸钠 | D.b可以是硫酸,也可以是盐酸 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、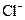 、Mg2+、Ba2+、
、Mg2+、Ba2+、 、
、 ,现取二等份溶液进行如下实验:(1)第一份加AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,得澄清溶液,并收集到气体0.03mol。上述澄清溶液冷却后,加足量BaC12溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
,现取二等份溶液进行如下实验:(1)第一份加AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,得澄清溶液,并收集到气体0.03mol。上述澄清溶液冷却后,加足量BaC12溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
①一定存在K+ ②一定存在Ba2+ ③可能存在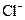 ④一定存在Mg2+
④一定存在Mg2+
⑤一定不存在 ⑥每份溶液中含0.01 mol
⑥每份溶液中含0.01 mol 
| A.①③⑤ | B.①③④⑤ | C.③⑥ | D.①③⑥ |
(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)="==" Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
如右图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体,这个多面体中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。



 (1)这个基本结构单元由 个硼原子组成,
(1)这个基本结构单元由 个硼原子组成,
 共含有 个B—B键。
共含有 个B—B键。


 (2)假设将此基本结构单元的每个顶角按一定比例且同等
(2)假设将此基本结构单元的每个顶角按一定比例且同等
 程度地削去(切点不重合),可得到另一个多面体,则此多面体含
程度地削去(切点不重合),可得到另一个多面体,则此多面体含 
 个五边形, 个六边形。若再设此多面体的每个交点处有一个碳
个五边形, 个六边形。若再设此多面体的每个交点处有一个碳
 原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为 。
原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为 。
物质间有下列转代关系:
(1)若C是可用于自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量是D的质量的25.8%,则A是 (写化学式)并写出A在一定条件下生成的C的化学方程式 。
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
(3)若C是水,B是无氧化合物,B在同系物中是相对分子质量最小的化合物;工业上用B与C在催化剂条件下制取A,A为常见的一种燃料。E能使紫色石蕊试液显红色,则由D生成E的反应类型为 。A、B、D、E中能与水形成氢键而易溶于水的是 (写结构简式)
两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。
(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有____________;装置C的作用是________________________;E中溶液变浑浊,D中的现象是________________________,证明分解产物有____________。
②乙二酸受热分解的化学方程式为____________________________________________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________________。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是____________________________________;实验后用F中的固体进行验证的方法是____________________________________(可另选试剂)。
锂—空气电池能够提供相当于普通锂离子电池l0倍的能量,因此它是最有前途的电池技术。下图是锂—空气电池放电和充电时的工作示意图。 
(1)图I中电极a是 极。
(2)用锂一空气电池电解100mL 0.5mol/L CuSO4溶液,当电池中消耗1.4g Li时,在阴极会析出 g铜。
(3)电池中间的固体电解质(含阳离子交换膜)能阻止H2O、N2、O2等物质的通过,防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
(4)当给图Ⅱ中的锂空气电池充电时,d极应接电源的 极,该电极的电极反应式为 。
某芳香族化合物A的结构简式是 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(1)E的分子式是 。
(2)关于上述各步转化中,下列说法正确的是 。
a. 以上各步没有涉及加成反应 b. E比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d . A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式:
(①分子中苯环上有三个取代基,且苯环上的一氯代物有两种②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号