高二化学第七套
化学与生活密切相关,下列说法不正确的是
| A.二氧化硫可广泛用于食品的漂白 |
| B.葡萄糖可用于补钙药物的合成 |
| C.聚乙烯塑料制品可用于食品的包装 |
| D.次氯酸钠溶液可用于环境的消毒杀菌 |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
下列说法正确的是
| A.分子晶体中一定存在分子间作用力,不一定存在共价键 |
| B.分子中含两个氢原子的酸一定是二元酸 |
| C.含有金属阳离子的晶体一定是离子晶体 |
| D.元素的非金属型越强,其单质的活泼性一定越强 |
下列关于化学键的叙述,正确的一项是
| A.离子化合物中一定含有离子键 |
| B.单质分子中均存在化学键 |
| C.含有非极性共价键的分子一定是单质分子 |
| D.含有共价键的化合物一定是共价化合物 |
下列有关化学用语表示正确的是
A.过氧化钠的电子式: |
B.氯原子的结构示意图: |
C.中子数为76、质子数为55的原子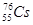 |
D.次氯酸的分子式:HClO;次氯酸的电子式: |
下列说法正确的是
| A.原子的电子层数越多,原子半径越大 |
| B.同族元素原子序数之差可能为16、26、36、46 |
| C.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D.卤族元素的单质均有氧化性,最高正价都是+7 |
下列说法不能证明氯的非金属性比硫强的是
| A.HCl比H2S稳定 |
| B.HClO4的酸性比H2SO4的酸性强 |
| C.向Na2S溶液中通入Cl2,溶液变浑浊 |
| D.向新制氯水中滴加Na2SO3溶液,氯水褪色 |
如下表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Y和氢三种元素形成的化合物中只有共价键 |
| C.原子得电子能力强弱:W<X<Y<Z |
| D.T元素的单质可能具有半导体的特性,T与Z元素可形成化合物TZ4 |
下列不能作为苯分子中碳原子间的化学键是一种介于C-C和C=C之间的特殊的化学键的依据的是
| A.苯不能使溴水褪色 | B.苯不能被酸性高锰酸钾溶液褪色 |
| C.邻二甲苯没有同分异构体 | D.苯分子中6个C原子共平面 |
从橙子中提取的柠檬酸是一种常用的食品添加剂,其结构为:
有关柠檬酸的性质叙述不正确的是
| A.柠檬酸中能发生酯化反应的官能团有2种 |
| B.1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C.1 mol柠檬酸与足量金属Na反应生成生成1.5 mol H2 |
| D.柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |
在t℃时,10L 0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
| t /min |
0 |
2 |
4 |
6 |
| V(O2)/L |
0.0 |
9.9 |
17.2 |
V=? |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min慢
B.反应至6min时,共产生O2 44.8L
C.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
D.反应至6min时,c(H2O2) = 0.3mol·L-1
把3 mol A和2.5 mol B混合于2 L密闭容器中,发生反应:3A(g)+B(g)  xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论错误的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论错误的是
| A.A的平均反应速率为0.15 mol/(L·min) |
| B.平衡时,C的浓度为0.25 mol/L |
| C.平衡时,B的转化率为20% |
| D.平衡时,容器内压强为原来的0.8倍 |
对于可逆反应 下列叙述能够说明反应已达平衡状态的是
下列叙述能够说明反应已达平衡状态的是
| A.各物质的物质的量浓度比为2∶1∶1 |
| B.压强保持不变的状态 |
| C.断裂2 mol H—I 键的同时生成1 mol I—I 键 |
| D.混合气体的颜色不再变化 |
下列说法正确的是
| A.除去溴苯中的溴,可加入过量的KI溶液后分液 |
| B.葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 |
| C.蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 |
| D.纤维素属于高分子化合物,与淀粉互为同分异构体 |
下列对于过氧化钠的叙述中,正确的是
| A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 |
| B.1 mol Na2O2与H2O完全反应,转移2 mol电子 |
| C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na |
| D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
下列关于油脂的叙述中,不正确的是
| A.油脂是酯的一种 |
| B.植物油和矿物油都不能使溴水褪色 |
| C.天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
| D.油脂在人体内的化学变化主要是在脂肪酶的催化下进行水解 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是
①氧化剂是H3AsO3;
②还原性:Cl->As;
③每生成1molAs,反应中转移电子的物质的量为3mol;
④M为OH-;⑤SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
关于下图装置中的变化叙述错误的是
| A.电子从锌片流向右侧碳棒,再从左侧碳棒流回铜片 |
| B.锌片上发生氧化反应 |
| C.左侧碳棒上发生:2H2O+O2+4e→4OH- |
| D.铜电极析出铜 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e- + H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e- + 2H2O = 4OH- |
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200oC左右供电。电池总反应为:C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用图所示装置探究废旧塑料的再利用。
下列叙述不正确的是
| A.聚丙烯的链节是—CH2—CH2—CH2— |
| B.装置乙的试管中可收集到芳香烃 |
| C.装置丙中可得到卤代烃 |
| D.最后收集的气体可做燃料 |
(4分)现有:①二氧化碳 ②甲烷 ③二氧化硫 ④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中。(填序号)
(1)天然气的主要成分是 ;
(2)医院检验糖尿病要用到的物质是新制的 ;
(3)造成温室效应和全球气候变暖的主要物质是 ;
(4)泄漏到空气中而产生酸雨的主要物质是 。
(13分)烯丙醇(CH2=CH—CH2OH)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)烯丙醇的分子式为 ;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气__ L。
(3)写出烯丙醇与溴水反应的化学方程式 ,反应类型为___________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为 ,酯化反应生成的产物在一定条
件下可以发生加聚反应得到高分子化合物,其结构简式为 。
(2分)冶炼金属的三种常用方法是:①热分解法 ②热还原法 ③电解法。(填序号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁的常用方法是 。
(12分)X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,交警可以用H2SO4酸化的K2Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式 。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
(16分)Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是_____
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O  2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO + 3H2
CO + 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。

①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ: 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。

③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。

①该电池正极的电极反应为__________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为________.
一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:__________________________________
(3)反应较长时间后气泡量又会明显增加的原因是_______________________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号