北京市西城区高三一模(理科综合)化学部分
下列事实不能用金属活动性解释的是
| A.生活中可用铝制的水壶烧水 |
| B.镀锌铁制品破损后,镀层仍能保护铁制品 |
| C.工业上常用热还原法冶炼铁,用电解法冶炼钠 |
| D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部 |
反应 的能量变化如右图所示。下列说法正确的是
的能量变化如右图所示。下列说法正确的是
A.12 g C(s)与一定量 (g)反应生成14 g CO(g),放出的热量为110.5 kJ (g)反应生成14 g CO(g),放出的热量为110.5 kJ |
B.2 mol C(s)与足量 (g)反应生成 (g)反应生成 (g),放出的热量大于221 kJ (g),放出的热量大于221 kJ |
C.该反应的热化学方程式是  |
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与 分子中化学键断裂时所吸收的总能量的差 分子中化学键断裂时所吸收的总能量的差 |
下列实验操作不能达到其对应目的的是
| 编号 |
实验操作 |
目的 |
| A |
取  加入96mL水中 加入96mL水中(水的密度近似看作1g/  ) ) |
配置4% 溶液 溶液 |
| B |
滴定实验中,用待测液润洗锥形瓶 |
避免造成误差使滴定结果偏低 |
| C |
向 溶液中滴入酚酞溶液,加热 溶液中滴入酚酞溶液,加热 |
证明升高温度能促进 水解 水解 |
| D |
向盛有铜片的试管中加入浓硫酸,加热 |
证明浓硫酸具有强氧化性 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2, 和
和 离子的电子数之差为8。下列说法不正确的是
离子的电子数之差为8。下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是 |
下列说法正确的是
A.将铁粉加入 、 、 混合溶液中,充分反应后剩余的固体中必有铁 混合溶液中,充分反应后剩余的固体中必有铁 |
B.将 和 和 混合气体分别通入 混合气体分别通入 溶液、 溶液、 溶液中,最终都有沉淀生成 溶液中,最终都有沉淀生成 |
C.检验某酸性溶液中 和 和 ,选用试剂及顺序是过量 ,选用试剂及顺序是过量 溶液、 溶液、 溶液 溶液 |
D.用加热分解的方法可将 固体和Ca(OH)2固体的混合物分离 固体和Ca(OH)2固体的混合物分离 |
下列说法正确的是
A.pH=5的 溶液或醋酸中,由水电离出的 溶液或醋酸中,由水电离出的 均为10 均为10 mol/L mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
C.在c(H ):c(OH ):c(OH )=1:10 )=1:10 的溶液中,Na 的溶液中,Na 、I 、I 、 、 、 、 能大量共存 能大量共存 |
D.0.1 mol/L 溶液和0. 1 mol/L 溶液和0. 1 mol/L 溶液等体积混合,溶液中 溶液等体积混合,溶液中 |

某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量( )如下表所示。下列说法正确的是
)如下表所示。下列说法正确的是
| |
X |
Y |
W |
 (起始状态)/mol (起始状态)/mol |
2 |
1 |
0 |
 (平衡状态)/mol (平衡状态)/mol |
1 |
0.5 |
1.5 |
A.该温度下,此反应的平衡常数表达式是 |
| B.升高温度,若W的体积分数减小,则此反应△H>0 |
| C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
D.该温度下,再向容器中通入3 mol W,达到平衡时, |
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积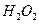 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 |
条件 |
现象 |
结论 |
|
| 1 |
温度/℃ |
催化剂 |
||
| 2 |
40 |
FeCl3溶液 |
|
|
| 3 |
20 |
FeCl3溶液 |
|
|
| 4 |
20 |
MnO2 |
|
|
| 5 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用 MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。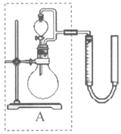
(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标 准状况),则此样品中:Na2O2的质量分数是 。
准状况),则此样品中:Na2O2的质量分数是 。
(10分)工业上以锂辉石(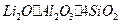 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: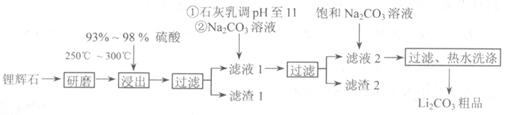
已知:①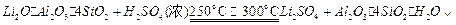
②某些物质的溶解度( )如下表所示。
)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。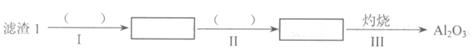
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。甲+乙 丙+丁
丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。
①若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。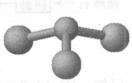
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原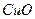 ,此反应的化学方程式是 。
,此反应的化学方程式是 。
③若甲是由N和O元素组成的气态物质,呈红棕色。将3.36 g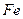 加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是 。
加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是 。
(3)Hofmann依据上述转化关系测定氨分子的组成。现用如右图所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至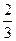 处。
处。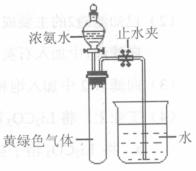
①滴下浓氨水一段时间后,试管内发生反应的化学方程式是 。
②证明试管内“不再反应”的实验操作和现象是 。
有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。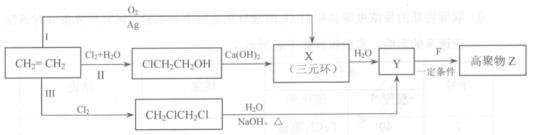
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、 “II”或“III”) 。
② X的结构简式是 。
③ l mol F在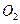 中充分燃烧,生成
中充分燃烧,生成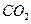 和
和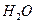 的物质的量之比为8:3,消耗7.5mol
的物质的量之比为8:3,消耗7.5mol 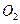 ,其核磁共振氢谱中有3个吸收峰,且能与
,其核磁共振氢谱中有3个吸收峰,且能与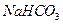 反应生成
反应生成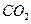 。
。
F分子中含有的含氧官能团的名称是 。
Y+F Z反应的化学方程式是 。
Z反应的化学方程式是 。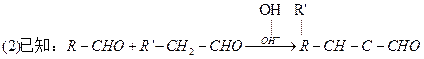 (
(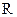 、
、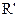 代表烃基或氢原子)
代表烃基或氢原子)
合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个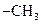 。
。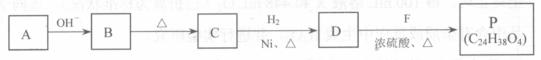
① A B反应的化学方程式是 。
B反应的化学方程式是 。
② B C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氯原子。C的结构简式是 。
C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氯原子。C的结构简式是 。
③ P的结构简式是 。
④符合下列条件的B的同分异构体共有(填数字) 种。
a.在酸性条件下水解为M和N b.一定条件下M可以转化为N
⑤已知: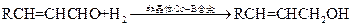 (R代表烃基或氢原子)
(R代表烃基或氢原子)
A的同系物W的相对分子质量为44。请参照示例写出以W和另一种有机物为原料合成肉桂醇(
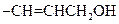 )的合成路线:
)的合成路线: 。
。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号