2009高考真题汇编-无机综合题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是:
| A. | 明矾水解形成的 胶体能吸附水中悬浮物,可用于水的净化 |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C. | 的熔点很高,可用于制作耐高温材料 |
| D. | 电解 饱和溶液,可制得金属镁 |
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:

(1)反应I前需在溶液中加入(填字母),以除去溶液中的。
| A. | 锌粉 | B. | 铁屑 | C. | 溶液 | D. |
(2)反应I需控制反应温度低35℃,其目的是。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:。
(4)反应Ⅳ常被用于电解生产(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为:。
向镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体。 向反应后的溶液中加入氢氧化钾溶液,使金属离子刚好沉淀完全,得到的
向反应后的溶液中加入氢氧化钾溶液,使金属离子刚好沉淀完全,得到的 沉淀质量为。再将得到的沉淀灼烧至质量不再改变为止,得到固体。则下列关系不正确的是( )
沉淀质量为。再将得到的沉淀灼烧至质量不再改变为止,得到固体。则下列关系不正确的是( )
| A. | B. | ||
| C. | D. |
 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 (1 )从废液中提纯并结晶处。
(1 )从废液中提纯并结晶处。
 (2)将溶液与稍过量的溶液混合,得到含
(2)将溶液与稍过量的溶液混合,得到含
 (3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到固体
(3)将浊液过滤,用90°C热水洗涤沉淀,干燥后得到固体
 (4)煅烧,得到固体
(4)煅烧,得到固体
 已知:在热水中分解
已知:在热水中分解
 (1)中,加足量的铁屑出去废液中的,该反应的离子方程式是。
(1)中,加足量的铁屑出去废液中的,该反应的离子方程式是。
(2)中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用。
 (3 )中,生成的离子方程式是。若浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(3 )中,生成的离子方程式是。若浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
 (4)中,通过检验来判断沉淀是否洗涤干净。检验操作是是。
(4)中,通过检验来判断沉淀是否洗涤干净。检验操作是是。
(5)已知煅烧的化学方程式是,现煅烧464.0的,得到316.8产品,若产品中杂质只有,则该产品中的质量是(摩尔质量/;)
 从铝土矿(主要成分是,含、、等杂质)中提取两种工艺品的流程如下:
从铝土矿(主要成分是,含、、等杂质)中提取两种工艺品的流程如下:



请回答下列问题:
 (1)流程甲加入盐酸后生成的方程式为.
(1)流程甲加入盐酸后生成的方程式为.
 (2)流程乙加入烧碱后生成的离子方程式为.
(2)流程乙加入烧碱后生成的离子方程式为.
 (3)验证滤液含,可取少量滤液并加入填试剂名称)。
(3)验证滤液含,可取少量滤液并加入填试剂名称)。
 (4)滤液中溶质的主要成份是(填化学式),写出该溶液的一种用途_
(4)滤液中溶质的主要成份是(填化学式),写出该溶液的一种用途_
 (5)已知298时,的容度积常数=5.6×10-12,取适量的滤液,加入一定量的烧碱达到沉淀溶液平衡,测得=13.00,则此温度下残留在溶液中的=.
(5)已知298时,的容度积常数=5.6×10-12,取适量的滤液,加入一定量的烧碱达到沉淀溶液平衡,测得=13.00,则此温度下残留在溶液中的=.
下列有关金属及其合金的说法不正确的是()
| A. |
目前我国流通的硬币是由合金材料制造的 |
| B. |
生铁、普通钢和不锈钢中的碳含量依次增加 |
| C. |
镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 |
| D. |
日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
实验室模拟合成氨和氨催化氧化的流程如下:





已知实验室可用饱和亚硝酸钠()溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从上图中选择制取气体的合适装置:
氮气、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(填"会"或"不会")发生倒吸,原因是:。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:,锥形瓶中还可观察到的现象是:。
(5)写出乙装置中氨氧化的化学方程式:。
(6)反应结束后锥形瓶内的溶液中含有、、、离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于上(用以下所给仪器的编号填入,下同),取用坩埚应使用,灼烧后的坩埚应放在上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.坩埚钳 F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:。
(5)在测定所得胆矾()中结晶水x值的实验过程中:称量操作至少进行次。
(6)若测定结果值偏高,可能的原因是。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
实验室将9铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所
 得固体中含金属单质为18,则该氧化物粉末可能是( )
得固体中含金属单质为18,则该氧化物粉末可能是( )


| A. | 和 | B. | 和 |
| C. | 和 | D. | 和 |
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:


①该反应的平衡常数表达式为:
②该温度下,在2盛有粉末的密闭容器中通入气体,10后,生成了单质铁11.2。则10内的平均反应速率为
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
 ①②
①②
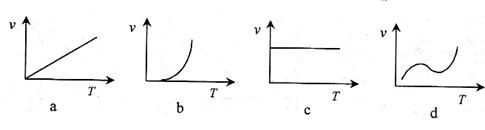
 (3)某些金属氧化物粉末和粉在镁条的引燃下可以发生铝热反应。下列反应速率()和温度()的关系示意图中与铝热反应最接近的是。
(3)某些金属氧化物粉末和粉在镁条的引燃下可以发生铝热反应。下列反应速率()和温度()的关系示意图中与铝热反应最接近的是。

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
(4)写出氢氧化铝在水中发生酸式电离的电离方程式: 欲使上述体系中浓度增加,可加入的物质是。
欲使上述体系中浓度增加,可加入的物质是。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:






族 周期 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:。
 (4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)。
 a. b. c. d.
a. b. c. d.
(5)由表中元素形成的常见物质可发生以下反应:


 溶液与溶液反应的离子方程式为,
溶液与溶液反应的离子方程式为, ⑥的单质的化学方程式为。
⑥的单质的化学方程式为。
 常温下,为使0.1溶液中由电离的阴、阳离子浓度相等,应向溶液中加入一定量的溶液至。
常温下,为使0.1溶液中由电离的阴、阳离子浓度相等,应向溶液中加入一定量的溶液至。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号