2009高考真题汇编—氧族元素,环境保护
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
 Ⅰ.测定过氧化的含量
Ⅰ.测定过氧化的含量
 请填写下列空白:
请填写下列空白:
(1) 移取10.00 密度为的过氧化氢溶液至250(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
移取10.00 密度为的过氧化氢溶液至250(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
 +
+
 (3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。
(3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。
 (4)重复滴定三次,平均耗用标准溶液,则原过氧化氢溶液中过氧化氢的质量分数为。
(4)重复滴定三次,平均耗用标准溶液,则原过氧化氢溶液中过氧化氢的质量分数为。
 (5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。
 Ⅱ.探究过氧化氢的性质
Ⅱ.探究过氧化氢的性质
 该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
 请将他们的实验方法和实验现象填入下表:
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
| 验证氧化性 |
||
| 验证不稳定性 |
 浓和木炭在加热时发生反应的化学方程式是
浓和木炭在加热时发生反应的化学方程式是

 ↑↑
↑↑
 请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓、木炭和酸性溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓、木炭和酸性溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)




 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器 (填字母) (填字母) |
加入的试剂 |
作用 |
     |
   |
   |

 反应过程的能量变化如图所示。已知1氧化为1的.请回答下列问题:
反应过程的能量变化如图所示。已知1氧化为1的.请回答下列问题:
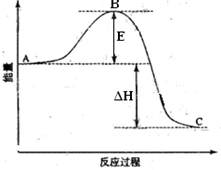
(1)图中点表示。的大小对该反应的反应热有无影响。该反应通常用作催化剂,加会使图中点升高还是降低,理由是;
(2)图中=;
(3)的催化循环机理可能为:氧化时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
,。
下列叙述正确的是
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:




 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整
 4+11
4+11
 (2)接触室中发生反应的化学方程式是。
(2)接触室中发生反应的化学方程式是。
 (3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
 b. 过量空气能提高的转化率
b. 过量空气能提高的转化率
 c. 使用催化剂能提高的反应速率和转化率
c. 使用催化剂能提高的反应速率和转化率
 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁
 (4)每160g气体与
(4)每160g气体与 化合放出260.6的热量,该反应的热化学方程是。
化合放出260.6的热量,该反应的热化学方程是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的和铵盐。
 ①既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的。吸收的离子方程式是。
①既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的。吸收的离子方程式是。
 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
 部分测定结果;
部分测定结果;
 铵盐质量为10.00和20.00时,浓硫酸增加的质量相同;铵盐质量为30.00时,浓硫酸增加的质量为0.68;铵盐质量为40.00时,浓硫酸的质量不变。
铵盐质量为10.00和20.00时,浓硫酸增加的质量相同;铵盐质量为30.00时,浓硫酸增加的质量为0.68;铵盐质量为40.00时,浓硫酸的质量不变。
 计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00。 浓硫酸增加的质量为。 (计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00。 浓硫酸增加的质量为。 (计算结果保留两位小数)
根据硫化氢气体的实验室制法和性质完成下列填空。
 (1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用()。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用()。

| A. |
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁 |

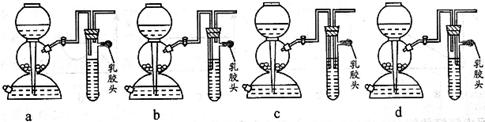
 (2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图中选择合适的仪器;
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图中选择合适的仪器;
 (填编号)。
(填编号)。



(3)如图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
 的现象是。
的现象是。


 (4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
 反应过程中,溶液的(填"变大"、"变小"或"不变")。
反应过程中,溶液的(填"变大"、"变小"或"不变")。

 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。如图的装置能起到此作用的是。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。如图的装置能起到此作用的是。



 (6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是。
(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号