2008年全国统一高考理综试卷(北京卷)化学部分
工业上制备纯硅反应的热化学方程式如下:
;
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高 的转化率 |
| B. | 若反应开始时 为1 ,则达到平衡时,吸收热量为 |
| C. | 反应至4 时,若 的浓度为0.12 ,则 的反应速率为0.03 |
| D. | 当反应吸收热量为0.025 时,生成的 通入100 1 的 恰好反应 |
由、、、、中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):


 (1)取少量溶液,加入过量的溶液,有沉淀生成。取上层清液,通入,无明显变化,说明样品中不含有的物质是(填化学式)。
(1)取少量溶液,加入过量的溶液,有沉淀生成。取上层清液,通入,无明显变化,说明样品中不含有的物质是(填化学式)。
 (2)为一种或两种气体:
(2)为一种或两种气体:
 ①若只为一种气体,试剂为饱和溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是。
①若只为一种气体,试剂为饱和溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是。
 ②若为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是。
②若为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是。
 (3)向中通入过量的,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。
(3)向中通入过量的,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。
 (4)取中的溶液,调节约为7,加入淀粉和,溶液呈蓝色并有红褐色沉淀生成。当消耗2时,共转移3电子,该反应的离子方程式是。
(4)取中的溶液,调节约为7,加入淀粉和,溶液呈蓝色并有红褐色沉淀生成。当消耗2时,共转移3电子,该反应的离子方程式是。
 (5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)。
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是。
(2)5.8 g甲完全燃烧可产生0.3 mol 和0.3 mol ,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是。
(3)苯氧乙酸有多种酯类的同分异构体。其中能与溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)。
(4)已知:



菠萝酯的合成路线如下:

①试剂X不可选用的是(选填字母)。
a.溶液 b.溶液
c.溶液 d.
②丙的结构简式是,反应Ⅱ的反应类型是。
③反应Ⅳ的化学方程式是。
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为溶液,下列有关该电池的叙述不正确的是()
| A. | 正极反应式为: |
| B. | 工作一段时间后,电解液中 的物质的量不变 |
| C. | 该燃料电池的总反应方程式为: |
| D. | 用该电池电解 溶液,产生2.24 L (标准状况)时,有0.1 电子转移 |
通常状况下,、和是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应常作为Y的鉴定反应。
(1)与的关系是(选填字母)。
a.同位素 b.同系物
c.同素异形体 d.同分异构体
(2)将和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法:。
(3)举出实例说明的氧化性比硫单质的氧化性强(用化学方程式表示):。
(4)气体与化学性质相似,也能与反应生成(其水溶液是一种酸)。
①分子中含有4个共价键,其结构式是。
②溶液显碱性,原因是(用离子方程式表示)。
(5)加热条件下,足量的与某金属M的盐(为碳元素)完全反应生成和(、均为正整数)。若质量为,质量为,M的相对原子质量为,则中∶=(用含、和的代数式表示)。
下列叙述正确的是()
| A. | 金属与盐溶液的反应都是置换反应 |
| B. | 阴离子都只有还原性 |
| C. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
| D. | 分子晶体中都存在范德瓦斯力,可能不存在共价键 |
、均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是()
| A. | 由 与 ,得 |
| B. | 的还原性一定大于 |
| C. | , 一定不是同周期元素 |
| D. | 若X的原子半径大于 ,则气态氢化物的稳定性 一定大于 |
、、、为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,有5个原子核。通常状况下,为无色液体。
已知:+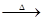 +(1)的电子式是。
+(1)的电子式是。
(2)液态和的电离相似,都可电离出电子数相同的两种离子,液态的电离方程式是。
(3)用图示装置制备并验证其还原性。有下列主要操作

a.向广口瓶内注入足量热溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤后还缺少的一步主要操作是。
②红磷充分燃烧的产物与溶液反应的离子方程式是。
③步骤滴入稀硝酸后烧杯中的现象是。
反应的离子方程式是。
(4)一定温度下,将1置于密闭容器中,保持压强不变,升高温度至的过程中,气体由无色逐渐变为红棕色。温度由继续升高到的过程中,气体逐渐变为无色。若保持,增大压强,气体逐渐变为红棕色。气体的物质的量随温度变化的关系如图所示

①温度在-之间,反应的化学方程式是。
②温度在-之间,气体的平均相对分子质量是(保留1位小数)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号