高考原创化学预测卷 06(浙江卷)
下列说法正确的是
| A.化学反应速率的测定中,若反应物溶液有颜色,可用比色法测定溶液颜色的深浅,再根据溶液颜色与反应物浓度的关系,换算成反应物在不同反应时刻的浓度值 |
| B.泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
| C.我国作为燃煤大国,酸雨的危害十分严重,安装烟气脱硫设施进行脱硫,吸收塔内浆液的pH值越高,越不利于SO2的吸收 |
| D.近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
下列说法正确的是
| A.从盛有液溴的试剂瓶中取用溴时,不应倾倒而应将一洁净的长胶头滴管伸到瓶底吸取 |
| B.Fe3+既能与硫氰化钾反应生成血红色的配合物,又能与K4[Fe(CN)6]反应生成蓝色溶液 |
| C.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| D.用标准NaOH标准液滴定盐酸,尖嘴部位滴定前无气泡,滴定后有气泡,则滴定结果偏大 |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2和RY3,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol·L-1X和W形成化合物的水溶液pH为2,下列说法正确的是
| A.非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 |
| B.在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C.原子半径由大到小排列的是:Z>R>W>Y>X |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
下列说法正确的是
A.按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷
B.化合物 的分子式为C13H8O4N2
的分子式为C13H8O4N2
C.聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色
D.经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84%
电解NO制备 NH4NO3的工作原理如图所示,X、Y均为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是
A.在阴极NO转化为B,B为硝酸根离子
B.电解一段时间,阴极附近pH升高
C.为使电解产物全部转化为NH4NO3,需补充的A为硝酸
D.该电解池的阳极反应式为:NO-3e-+4OH-==NO3-+2H2O
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液pH一定为14-a
B.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:2c(Na+)=2c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
某工业废水含有下列离子中的5种(不考虑水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察火焰无紫色。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中难以确定Cl-的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子是否存在 |
| D.步骤③中的白色沉淀为2种钡盐 |
(10分)已知有机物E的相对分子量小于160,其中氧的质量分数约为48.5%,E中无支链,E及其它有机物之间的相互转化关系如图:

(1)C中所含官能团的名称 ;指出⑤的反应类型 。
(2)E的摩尔质量为 ;写出E的结构简式 。
(3)写出反应②的化学方程式 。
写出反应③的化学方程式 。
(4)能发生银镜反应的C的同分异构体,写出不同类型的两个结构简式(多个羟基不能连在同一个碳原子上) 、 。
(18分)I.A与SO2属于等电子体(即具有相同的原子总数和相同的最外层电子总数的微粒),常温下是一种无色的气体,当冷却到77 K时,变成橙红色液体。A的一种制备方法是:在真空中,将CuO和单质硫混合加热,可生成A,同时生成一种黑色固体B。
(1)写出上述制备A的化学反应方程式 。
(2)若将S2Cl2与CuO在100~400℃加热时也能生成A。写出相应的化学反应方程式 。
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强)。则这两种酸由强到弱的化学式分别为 和 。
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物;A、B、C、D焰色反应均呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,相对分子质量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76 g·L-l。
(1)写出化合物E的电子式 。
(2)X的沸点比同主族同类型物质要高,原因是 。
(3)写出E与X反应的化学方程式 。
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 。
(5)A的一个重要应用是根据2A→P+H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,P的化学式 ,由A得到P的反应 (填“是”或“否”)氧化还原反应。
(15分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)==2Fe(s)+3CO(g) △H1=+489.0kJ•mol-1,C(s)+CO2(g)==2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液),写出该电池的负极反应式: 。
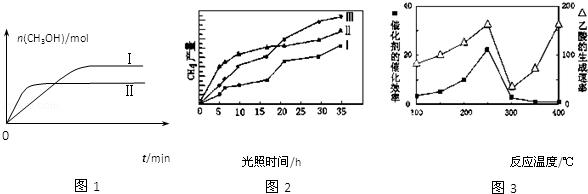
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
1mol CO2、3mol H2 |
a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是 。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式 。
(15分)三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3•5H2O]的实验流程如图所示:

①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3•5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3•5H2O含量偏低的是 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3•5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤; ;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3•6H2O; ,得到无水FeCl3。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号