高考原创化学预测卷 06(广东卷)
生活中处处有化学。下列说法不正确的是
| A.涂油层、电镀金属层、制合金等都是保护金属的措施 |
| B.作调味品的乙酸和乙醇都含有羟基,二者互为同系物 |
| C.利用油脂在碱性条件下的水解,可以制甘油和肥皂 |
| D.盐析可提纯蛋白质并能保持蛋白质的生理活性 |
在溶液中能大量共存,通入SO2后有沉淀生成的离子组是
| A.Mg2+、Na+、SO42-、Cl- | B.Al3+、Na+、ClO-、I- |
| C.K+、NH4+、Br-、S2- | D.Fe3+、Ba2+、HCO3-、NO3- |
下列叙述I和II均正确且具有因果关系的是
| 编号 |
叙述I |
叙述II |
| A |
碘易升华 |
可以用加热的方法除去氯化铵中的碘 |
| B |
硅酸钠溶液呈碱性 |
硅酸钠常用作木材的防火剂 |
| C |
Fe(SCN)3是一种不溶于水的红色物质 |
可用KSCN溶液检验Fe3+ |
| D |
Zn具有还原性和导电性 |
锌可用作锌锰干电池的电极材料 |
设NA为阿伏伽德罗常数的数值。下列说法正确的是
| A.标准状况下,0.1mol氯气与足量的氢氧化钠溶液反应转移电子数为0.1NA |
| B.标准状况下,0.224L乙烷中含有共价键的数目为0.06NA |
| C.4.0g重水(D2O)中所含中子数为1.6NA |
| D.常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA |
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法正确的是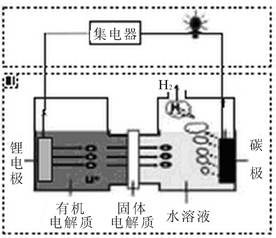
| A.碳极发生氧化反应 |
| B.有机电解质和水溶液不可以互换区域 |
| C.Li电极电极反应式为Li++e-=Li |
| D.若电源工作时产生标准状况下1.12 LH2,则有0.1mol电子通过有机电解质传递到正极 |
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.含氧酸的酸性:N>M |
| B.Y2M和Y2X2中化学键类型和阴、阳离子的个数比均不相同 |
| C.气态氢化物的还原性和沸点均是:X>M |
| D.在一定条件下M和N的单质均能溶解在Y的最高价氧化物对应的水化物中 |
常温下,盐酸和一元碱MOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HCl) |
c(MOH) |
||
| ① |
0.1 |
0.1 |
5 |
| ② |
0.2 |
x |
7 |
| ③ |
0.1 |
0.2 |
10 |
| ④ |
0.2 |
0.1 |
y |
下列判断正确的是
A.实验①反应后的溶液中:c(MOH)约为1×10—5mol·L-1
B.实验②反应后的溶液中:c(MOH)>c(M+)=c(Cl-)>c(H+)=c(OH-)
C.实验③反应后的溶液中:c(M+)+c(H+)=c(OH-)+c(MOH)
D.实验④反应后的溶液中:c(H+)-c(OH-)-c(MOH)=0.05 mol·L-1
下述根据下列操作和现象,所得结论不正确的是
| |
实验操作及现象 |
实验结论 |
| A |
分别向2 mL 0.1 mol/L CH3COOH溶液和2 mL 0.1 mol/LH3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 |
酸性: CH3COOH>H2CO3>H3BO3 |
| B |
向浓度均为0.1 mol/L NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 |
溶度积: Ksp(AgCl)<Ksp(AgI) |
| C |
向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 |
证明生成了乙烯 |
| D |
将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 |
氧化性:Br2>I2 |
拉氧头孢钠是一种抗生素,合成拉氧头孢钠中间体G的路线如下(部分反应物、反应条件略去):
(1)A与浓硝酸发生反应①的条件是__________,反应②的反应类型是______________;
(2)F分子中官能团的名称是______________________;
(3)写出反应③的化学方程式____________________________;.
(4)D的同分异构体有多种,写出一种符合下列条件的异构体M的结构简式_______________;
Ⅰ.苯环上一氯代物只有两种;Ⅱ.遇氯化铁溶液不变色;Ⅲ.1molM最多能与2molNaOH反应;Ⅵ.核磁共振氢谱只有4个峰。
(5)已知:① ;
;
②当苯环上已有一个“−CH3”或“−Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“−NO2”或“−COOH”时,新引入的取代基一般在它的间位。
请写出以甲苯、乙醇为原料制备 的合成路线图(无机试剂任用)。
的合成路线图(无机试剂任用)。
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图1所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图2所示。

①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在图2中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
某学校化学课外活动小组的同学用粗铜(含杂质铁)按如下流程回收氧化铜晶体(CuCl2·2H2O)等相关物质。请回答下列问题:

已知Cu2+、Fe3+沉淀时的相关PH:
| |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
| Cu2+ |
4.7 |
6.7 |
| Fe3+ |
1.9 |
3.2 |
(1)为得到固体I.同学们设计下图装置:

①添加药品之前,如何检查装置A的气密性________________。
②整套装置有不足之处,要完成实验必须改进的是__________________。
③装置D的作用是__________________(用离子方程式表示)。
(2)操作Ⅱ和操作Ⅴ相同,其中所需的主要玻璃仪器有烧杯______、_______。
(3)试剂X用于调节pH以除去杂质。
①试剂X可以是_________(填字母序号)。
a.NaOH b.Cu(OH)2 c.Na2CO3 d.CuO
②为使CuCl2溶液中的Fe3+完全除去,溶液pH范围应保持在______,当溶液的pH=4时,c(Fe3+)=_____。[Fe(OH)3的KSP=4.0×10-38]
(4)由溶液Ⅳ欲获得氯化铜晶体(CuCl2•2H2O),应采取的措施是________。
(5)由溶液Ⅳ获得 CuCl2·2H2O晶体过程中,有同学发现溶液颜色由蓝色变为绿色进而变成黄绿色,经查阅资料发现氯化铜溶液中存在以下平衡关系:

取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中不能证明CuCl2溶液中有上述转化关系的是___(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、SiO2、Al(OH)3中的一种或几种物质组成,牙膏中其他成分均可溶于益酸,且无气体产生。
(1)牙膏中添加甘油主要作用____。
为进一步探究牙膏中摩擦剂成分,进行了以下探究:
I摩擦剂成分的定性检验:设计实验方案,验证假设。请写出实验步骤以及预期现象和结论(可不填满也可补充)。可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 |
有难溶物存在 |
| 步骤2: |
①有无色气泡产生,说明有CaCO3; ②_________,说明有______。 |
| 步骤3: |
|
| …… |
|
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其主要作用 。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:① 。② 。
(4)下列各项措施中,能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,洌得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____。若改测定C中生成BaCO3质量为测定装置C在吸收CO2前后的质量差来确定CaCO3的质量分数,两方法测定的结果____(填“相同”或“不同”),原因是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号