山东省济宁市高三第一次模拟考试理综化学试卷
运用化学知识判断,下列说法正确的是
| A.地沟油的主要成分是高级脂肪酸甘油酯,可食用 |
| B.NOx、SO2、CO2、PM2.5颗粒都会导致酸雨 |
| C.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 |
| D.石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气态烯烃 |
下列说法正确的是
| A.标况下,1.12LCl2溶于水,转移0.05NA电子 |
| B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3·H2O |
| C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、:Na+、NO3-可能大量共存 |
| D.葡萄糖(C6H12O6)溶液中:SO42-、MnO42-、K+、H+可以大量共存 |
下列实验装置或操作正确的是
| A.图l烧杯中通入过量的CO2出现白色沉淀,则溶液中一定含有A1O2- |
| B.图2装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
| C.图3装置可以除去乙醇中的乙酸 |
| D.图4装置可以比较碳酸钠、碳酸氢钠的热稳定性 |
下列说法不正确的是
A.乙烯、乙醇均能使酸性高锰酸钾溶液褪色
B.通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷
C.淀粉、纤维素都属于糖类,它们通式相同,但它们不互为同分异构体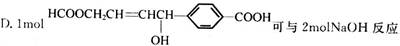
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g·L-1;Y、M、W的最高价氧化物的水化物。两两间都能发生反应。下列说法不正确的是
A.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
B.含有W阳离子的某种盐,可用作净水剂
C.M的单质可保存于煤油中
D.由X、Y、Z 种元素形成的某种化合物的水溶液,可能呈碱性或酸性
下列说法中不正确的是
| A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<O,则该反应能自发进行 |
| B.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a |
| C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+) |
| D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液中水的电离程度相同 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2 N2O5 (g)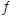 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表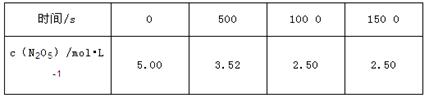
下列说法中不正确的是
| A.T1温度下,500s时O2的浓度为0.74mol·L-1 |
| B.平衡后其他条件不变。将容器的体积压缩到原来的l/2,则再平衡时c(N2O5)> 5.00mol·L-1 |
| C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2则K1<K2 |
| D.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5 |
(16分)“C 1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2 (g)+3H2(g) CH3OH g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
请回答:
①a=_______。
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_________mol·L-1·S-1
(2)甲烷的一个重要用途是制取H2,其原理为:CO2 (g)+ CH4 (g)  2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2(填“大于”或“小于”);压强为P2时,在y点:
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2(填“大于”或“小于”);压强为P2时,在y点: (正)_________
(正)_________ (逆)(填“大于”、“小于”或“等于”)。
(逆)(填“大于”、“小于”或“等于”)。
(3)一定条件下,治理汽车尾气的反应是 

 。在恒温恒容的密闭容器中通入
。在恒温恒容的密闭容器中通入 的混合气体,发生上述反应。下列图像正确且能说明反应在进行到
的混合气体,发生上述反应。下列图像正确且能说明反应在进行到 时刻一定达到平衡状态的是__________(选填字母)。
时刻一定达到平衡状态的是__________(选填字母)。
(4)甲酸(HCOOH)是一种弱酸,现用0.1mol·L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1叫的盐酸和甲酸溶液,滴定曲线如下:
滴定开始前,三种溶液中由水电离出的c(H+)最大的是_________;V1和V2的关系V1_________V2(填“>”、“=”或“<”);M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b.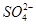 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液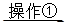 白色沉淀
白色沉淀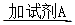 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。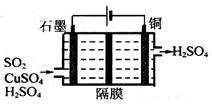
(3)已知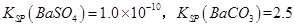
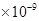 。某同学设想用下列流程得到BaCl2,
。某同学设想用下列流程得到BaCl2,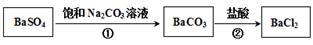
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生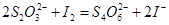 反应
反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示: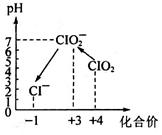
请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
(19分)某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:
探究一:用下图所示装置进行实验,回答下列问题:
(1)仪器组装完成后,夹好止水夹,__________.则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是_________(填选项)
| A.稀硫酸和锌片 | B.稀硝酸和铁片 |
| C.氢氧化钠溶液和铝片 | D.浓硫酸和镁片 |
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号)
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用___________方法收集氢气。
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确_________。(填“是”或“否”)若填“否”,则原因是_________(用离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体。
证明样品中一定含有__________,取少量反应后的溶液,加适量蒸馏水稀释后,滴加_________(填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中 有1.0mol,则样品中
有1.0mol,则样品中 ___________mol。
___________mol。
选做(12分)【化学一化学与技术】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、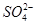 、Br-、
、Br-、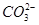 、
、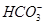 等离子。
等离子。
合理利用海水资源和保护环境是我国可持续发展的重要保证。
I.火力发电燃煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: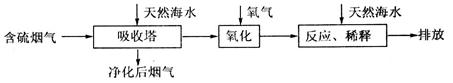
(1)天然海水的pH≈8,呈弱碱性。用离子方程式解释原因___________________________。
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是_______。氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________________________________________________________。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水( )中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入_________(填字母序号),沉淀效果最好。
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中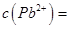 ________。
________。
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%。
若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag)+=__________,是否符合排放标准__________(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
选做(12分)【化学一物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布式为_________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式)。
(3)B元素可形成多种单质。一种晶体结构如图一所示,其原子轨道的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为_________g·cm-3(保留两位有效数字)。(已知: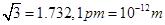 )
)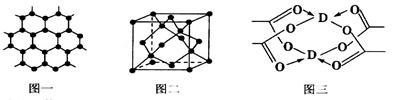
(4)D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式:_________________。
选做(12分)【化学一有机化学基础】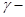 聚谷氨酸(
聚谷氨酸(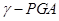 )是一种具有水溶性、可生物降解、可食用的对人体和环境无毒的高分子聚合物,广泛应用于食品和医药等领域。下图是根据实际需要和目的,对
)是一种具有水溶性、可生物降解、可食用的对人体和环境无毒的高分子聚合物,广泛应用于食品和医药等领域。下图是根据实际需要和目的,对 聚谷氨酸
聚谷氨酸 中的羧基进行化学修饰的路线,其中B、C、F均为高分子化合物。
中的羧基进行化学修饰的路线,其中B、C、F均为高分子化合物。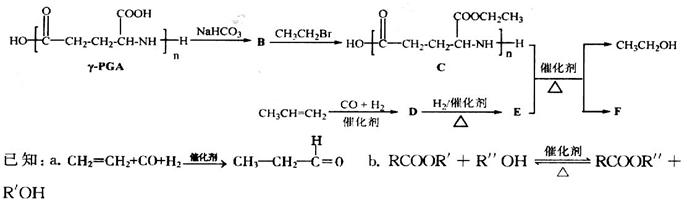
请回答:
(1)C的单体的结构简式为__________。D→E的反应类型是_________。
(2)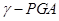 与NaHCO3溶液反应,可观察到的实验现象是_________。
与NaHCO3溶液反应,可观察到的实验现象是_________。
(3)下列关于CH3CH=CH2的说法中,正确的是__________(填字母序号)。
a.能使KMnO4酸性溶液褪色
b.它的同分异构体环丙烷属于不饱和烃
c.与HBr发生加成反应可得到两种产物
d.可以用溴的四氯化碳溶液鉴别丙烯和丙炔
(4)D的核磁共振氢谱有4个吸收峰,D发生银镜反应的化学方程式为:______________________。
(5)E与邻苯二甲酸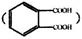 反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一。DBP有多种同分异构体,其中符合下列条件的DBP的结构简式_____________________
反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一。DBP有多种同分异构体,其中符合下列条件的DBP的结构简式_____________________
a.1mol化合物能与2molNaHCO3反应
b.苯环上只有两个相同的无支链取代基
c.苯环上的一氯取代物有三种
 粤公网安备 44130202000953号
粤公网安备 44130202000953号