福建省泉州五校高三上学期摸底联考化学试卷
化学与生活、社会密切相关。下列说法不正确的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.用废旧皮革生产药用胶囊可以提高原子利用率 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
下列化学用语描述中不正确的是
A.中子数为20的氯原子: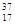 Cl Cl |
B.比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 |
C.HCO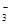 的电离方程式为:HCO 的电离方程式为:HCO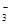 + H2O + H2O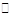 CO CO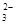 +H3O+ +H3O+ |
| D.次氯酸的结构式:H-O-Cl |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.0.1mol —NH2(氨基)中含有的电子数目为1.0NA |
| B.常温下,1L 0.1mol·L-1 CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA |
| C.标准状况下,2.24 LH2O中含有的原子总数为3NA |
| D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
下列说法正确的是
| A.酸、碱、盐都是电解质 | B.电解质都是易溶于水的物质 |
| C.氧化物都是电解质 | D.氢化物都不是电解质 |
下列表示化学反应的离子方程式,其中正确的是
| A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3 |
B.NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH- NH3↑+SO32-+H2O NH3↑+SO32-+H2O |
C.明矾溶于水产生Al(OH)3胶体: Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
| D.FeCl3溶液与Cu反应:Fe3++Cu = Fe2++ Cu2+ |
下列关于有机物的说法正确的是
| A.棉花、羊毛、蚕丝均属于天然纤维素 |
| B.石油的分馏和裂化均属于化学变化 |
| C.油脂都不能使溴的四氯化碳溶液褪色 |
| D.甲烷、乙醇、乙酸在一定条件下都能发生取代反应 |
在一无色溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+③ Cl-④ NO3-⑤S2-⑥CO32-⑦ NH4+⑧Mg2+⑨Al3+ ⑩AlO2-离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
| A.③⑤⑥⑦⑩ | B.①②⑤⑥⑧⑨ | C.③④⑦⑧⑨ | D.①②③⑤⑥⑩ |
用下列实验装置和方法进行相应实验,能达到实验目的的是
| A.用图1所示方法检查装置的气密性 |
| B.用图2所示装置和方法制取氨气 |
| C.用图3所示装置和方法进行石油分馏 |
| D.用图4装置和方法分离乙醇与乙酸 |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述 ①与水反应都是氧化还原反应;②与水反应后的溶液都显碱性;③与盐酸反应都只生成一种盐;④两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
| A.①②③④ | B.①②③ | C.②③ | D.② |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系, 则乙可能是
则乙可能是
| A.Al(OH)3 | B.H2SiO3 | C.FeCl2 | D.CH3C1 |
下列说法正确的是
| A.分散系中分散质粒子的大小:Fe (OH)3悬浊液<Fe (OH)3胶体<FeCl3溶液 |
B.可利用反应2CO=2C+O2(此反应 H>O、 H>O、 S<0)来消除CO污染 S<0)来消除CO污染 |
| C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB |
| D.除去Cu粉中混有的CuO,可加入稀硝酸中,充分反应后过滤、洗涤、干燥 |
有关实验的叙述,正确的是
| A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D.读取滴定管内液体的体积,俯视读数导致读数偏小 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列说法不正确的是
| A.在熔融电解质中,O2-向负极定向移动 |
| B.电池的总反应是:2C4H10+13O2===8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+4e-===2O2- |
| D.通入丁烷的一极是负极,电极反应为:C4H10 +26e-+13O2-=== 4CO2↑+5H2O |
100mL浓度为2mol·L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有
| A.加适量6mol·L-1HCl溶液 |
| B.加数滴CuCl2溶液 |
| C.加适量醋酸钠固体 |
| D.加适量NaNO3溶液 |
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
| A.X与Y能形成两种常见的气态化合物 |
| B.原子半径的大小顺序:r(Z)>r(R)> r(X)>r(Y) |
| C.X、Z分别与R形成的化合物中化学键类型不同 |
| D.含有Y、Z、R三种元素的化合物最多只有2种 |
下列依据相关实验得出的结论正确的
| A.SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物 |
| B.用大理石和浓盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中,出现白色沉淀证明H2CO3的酸性比H2SiO3的酸性强 |
| C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42- |
| D.相同体积PH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
SO2和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
用淀粉-KI鉴别FeCl2 |
Fe2+有氧化性 |
| C |
盐酸和氨水能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
| D |
CuSO4可以用作消毒剂 |
铜盐能使蛋白质变性 |
下列溶液中有关物质的浓度关系正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4) > c( (NH4)2SO4)> c(NH4Cl) |
| B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
在密闭容器中,对于可逆反应A+3B  2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
| A.若正反应方向△H <0,则T1> T 2 |
| B.压强增大时,混合气体的密度减小 |
| C.A一定为气体 |
| D.B一定为气体 |
下列图示与对应的叙述相符的是
| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
(1)T的原子结构示意图是______。用化学方程式表示工业上常用于冶炼T单质的原理是_________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________ 。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是___________。
(4)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式___________________________________。
、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=" -76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g)
C H4 (g)+2 H2O(g)
向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-
则阳极的电极反应式为__________________ _。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: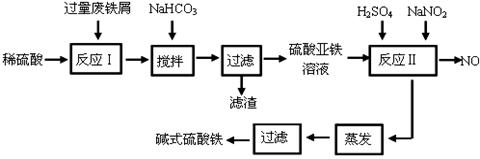
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9. 7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为 。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将
会 (填“偏高” “偏低” “不变”)
实验室中利用下图所示装置制备纳米碳酸钙(1纳米=1×10-9m)(部分夹持装置已略去),向饱和CaCl2溶液中通入NH3和CO2可制得纳米碳酸钙
供选择的药品:①石灰石 ②氯化铵 ③氢氧化钙 ④饱和氯化钙溶液 ⑤浓硫酸
⑥6 mol·L-1盐酸 ⑦饱和食盐水 ⑧饱和NaHCO3溶液
(1)装置A中,仪器a的名称是 ,仪器b中应盛放的固体为 。(填药品序号)。装置B 中盛放的溶液是 (填药品序号)。装置D的试管中发生反应的化学方程式为 。
(2)如何判断所得碳酸钙颗粒是否为纳米级。 。
(3)通入适量气体后,C装置中物质恰好完全反应,过滤,所得滤液显 (填“酸”、“碱”、“中”之一)性。
(4)装置C中, 右边的导管并未插入液面,原因是
(5)上述装置存在一处缺陷,该缺陷为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号