课时同步练习(人教版)10-1常见的酸和碱
小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系.图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示的颜色,则其中表示不正确的是( )
A.紫色
B.蓝色
C.红色
D.无色
某同学从资料上获悉,一些紫色的叶或花瓣浸出液有类似石蕊试液的性质。如果他想知道紫色喇叭花是否具有这种性质,应把花瓣浸出液分别滴入下列哪种物质进行观察( )
| A.食醋、碱性肥皂水 | B.食醋、酸奶 |
| C.糖水、酸奶 | D.食醋、食盐水 |
小冬在自制酸碱指示剂的探究活动中,记录如下.根据下表判断,其中不能作指示剂的是( )
| |
植物的汁液 |
在酸性溶液中 |
在中性溶液中 |
在碱性溶液中 |
| A |
牵牛花瓣 |
红色 |
紫色 |
蓝色 |
| B |
胡萝卜 |
橙色 |
橙色 |
橙色 |
| C |
紫萝卜皮 |
红色 |
紫色 |
黄绿色 |
| D |
月季花瓣 |
浅红色 |
红色 |
黄色 |
物质的性质决定用途,根据所学化学知识,判断下列说法错误的是( )
| A.苛性钠用于治疗胃酸过多 |
| B.食盐可用于配制生理盐水 |
| C.熟石灰用于中和酸性土壤 |
| D.稀硫酸溶液用于清除铁锈 |
已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
| A.能与二氧化碳反应 |
| B.能使无色酚酞溶液变红 |
| C.能与稀硫酸反应 |
| D.能使紫色石蕊溶液变红 |
有关浓硫酸的说法,错误的是( )
| A.浓硫酸具有吸水性,在实验室中常用作干燥剂 |
| B.浓硫酸具有强腐蚀性,它能使纸张、布料、皮肤等脱水碳化 |
| C.浓硫酸溶于水时会吸收大量的热,可作制冷剂 |
| D.如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液 |
如右图所示,在小烧杯甲中装入滴有酚酞的蒸馏水,在小烧杯乙中装入浓氨水并用一只大烧杯把甲、乙罩在一起。几分钟后,发现甲中的溶液变成红色.对上述现象的解释正确的是( )
①甲烧杯溶液变色是因为酚酞滴入溶液后,要过一会儿才能变色,所以甲溶液变色与乙无关;
②大烧杯壁上沾有某种物质,散发出的肉眼看不见的微粒与甲中的溶液接触,使其变红;
③乙中的浓氨水中有肉眼见不到的微粒逸出,有些微粒进入了甲中的溶液,使溶液成分改变,并使溶液变红.
④氨水能使酚酞溶液变红
| A.①② | B.③④ | C.①④ | D.②③ |
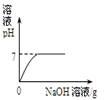
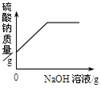
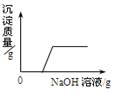
圆梦中学化学兴趣小组为了研究露置的氢氧化钠变质情况,小李和同学取了实验室中露置的NaOH样品在烧杯中配成溶液,并向其中逐滴滴加稀盐酸直至过量,下列图像能正确反映其中变化的是( )
对某无色溶液进行下列实验,根据实验现象得出的结论中,不正确的是( )
| A.滴入紫色石蕊溶液,颜色变红,则该溶液显酸性 |
| B.滴入酚酞溶液,溶液保持无色,则该溶液显酸性 |
| C.加入镁粉,有气泡产生,则该溶液显酸性 |
| D.加入CaCO3固体,有气泡产生,则该溶液显酸性 |
观察和实验是学习化学的重要方式,下列实验中观察到的颜色变化正确的是( )
| A.紫色石蕊溶液滴入氢氧化钠溶液中变红色 |
| B.无色酚酞溶液滴入硫酸溶液中变红色 |
| C.铁锈放入稀盐酸中溶液变黄色 |
| D.硫酸铜溶液中滴加氢氧化钠溶液会出现红褐色沉淀 |
下列说法错误的是( )
| A.浓盐酸敞口放置一段时间后,溶液的质量会减小 |
| B.浓盐酸在空气中会冒白烟 |
| C.浓硫酸敞口放置一段时间后溶液的质量会增加 |
| D.浓硫酸溶于水时会放出大量的热 |
人们对事物的认识常需经历一个不断修正和完善的过程。人们对于酸的认识就是如此。下列各项是不同时期对酸的认识,其中与我们现在所学酸的定义最相近的是( )
| A.只要是有酸味的物质,就是酸 |
| B.一切酸中都含有氧 |
| C.酸中只有氢元素才是不可缺少的 |
| D.只要是与碱作用时失去原有性质的物质都叫酸 |
运用曲线图像可以很好的体现参加反应的物质间,各物质质量关系的变化情况。现向盛有H2SO4和CuSO4的混合溶液的烧杯中逐滴加入NaOH溶液至过量,下列图象表示反应的有关变化情况正确的是( )
A B C D
食醋是一种厨房常用的调味品.某同学要进行实验验证食醋具有与盐酸相似的化学性质,他选择了下列物质,其中不能达到目的的是( )
| A.铜 |
| B.铁锈 |
| C.锌粒 |
| D.紫色石蕊溶液 |
氢氧化铯是一种可溶性碱,其化学式为CsOH,是制取各种铯盐的原料.下列叙述不正确的是( )
| A.CsOH溶液能使紫色石蕊试液变蓝 |
| B.无色酚酞试液遇CsOH溶液不变色 |
| C.CsOH溶液中含有OH- |
| D.CsOH与CO2反应生成Cs2CO3和H2O |
下列说法正确的是( )
| A.盐酸能使紫色是蕊溶液变蓝 |
| B.浓硫酸置于空气中,溶质的质量分数变大 |
| C.露置于空气中的固体氢氧化钠,其成分不会发生变化 |
| D.打开盛浓盐酸的试剂瓶,瓶口会成产生白雾 |
盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质.下列有关叙述正确的是( )
| A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾 |
| B.稀盐酸和稀硫酸都可用于除铁锈 |
| C.浓盐酸、浓硫酸都可用来干燥氧气 |
| D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀生成 |
小明在一次家庭实验时,将铜片和锌片用导线连接后插入番茄里,如图所示,电流表指针发生偏转,可见番茄液内含有( )
| A.自由移动的离子 |
| B.自由移动的分子 |
| C.自由移动的原子 |
| D.自由移动的电子 |
“接叶连枝千万绿,一花两色浅深红”是对玫瑰花生动的写照.我市苦水玫瑰远近闻名,某同学用“玫瑰花瓣”的汁液自制酸碱指示剂,有关记录如下表:
| |
在酸性溶液中 |
在中性溶液中 |
在碱性溶液中 |
| 玫瑰花瓣的汁液 |
浅红色 |
红色 |
棕黄色 |
向滴有少量该指示剂的NaOH溶液中逐渐滴加稀盐酸至过量,颜色变化是( )
A.由浅红色变红色
B.由棕黄色变浅红色
C.由浅红变棕黄色
D.由红色变棕黄色
已知氢氧化锂(LiOH)可溶于水,其他性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
| A.能与二氧化碳反应 | B.能使无色酚酞试液变红 |
| C.能与稀硫酸反应 | D.能使紫色石蕊试液变红 |
如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是( )
| A.指针偏左,食盐溶液一定变稀,烧碱潮解 |
| B.指针偏右,食盐溶液一定饱和,烧碱潮解 |
| C.指针偏左,食盐溶液一定变浓,烧碱潮解 |
| D.指针偏右,食盐溶液一定变浓,烧碱潮解 |
初中化学教材中的“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动.食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是( )
①除去菜刀上的铁锈
②鉴别食盐和纯碱
③检验鸡蛋壳能否溶于酸
④除去热水瓶中的水垢
| A.①②③④ |
| B.①③ |
| C.②④ |
| D.②③④ |
小明想除去卫生间瓷砖上的铁锈痕迹,在用清水洗涤之前,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是( )
| A.汽油 |
| B.食盐水 |
| C.白醋 |
| D.自来水 |
氢氧化钠和氢氧化钙都属于常见的碱。下列关于它们的说法正确的是( )
| A.都能用作建筑材料 |
| B.都能用作某些气体的干燥剂 |
| C.它们的溶液都能用于检验二氧化碳气体 |
| D.它们的溶液都能用于吸收二氧化硫气体 |
下列有关氢氧化钠性质的说法错误的是( )
| A.氢氧化钠有腐蚀性 |
| B.固体氢氧化钠有挥发性 |
| C.氢氧化钠能吸收二氧化碳而变质 |
| D.固体氢氧化钠能吸收水蒸气而潮解 |
在常温时,将水银温度计插入下列某种液体中,取出温度计放置在空气中后,温度计的示数先升高再降低,则可推断温度计插入的液体是( )
| A.食盐水 |
| B.酒精 |
| C.浓硫酸 |
| D.浓盐酸 |
下图是两种稀酸与铁铬合金反应随铬(Cr)的质量分数变化的实验结果(铬与稀酸反应).下列说法错误的是( )
| A.稀硫酸、稀盐酸中的阳离子都是H+ |
| B.图中的“5%”表示酸溶液中溶质的质量分数 |
| C.同一种酸与铁铬合金的反应速率会随着Cr质量分数的增加一直加快 |
| D.与相同铁铬合金反应,5%的硫酸比5%的盐酸反应速率快 |
实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )
| A.浓盐酸——防止挥发 |
| B.NaOH溶液——防止与CO2反应 |
| C.浓硫酸——防止吸水 |
| D.生石灰——防止与氧气反应 |
氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
| A.都能与指示剂作用 |
| B.都能解离出氢氧根离子 |
| C.都能解离出金属阳离子 |
| D.都含有氢元素和氧元素 |
如图所示,将密闭的相互连接的装置放在天平上,调节天平使之平衡,经过一段时间后,下列有关叙述正确的是( )
| A.指针偏左,食盐溶液一定变稀,烧碱潮解 |
| B.指针偏右,食盐溶液一定饱和,烧碱潮解 |
| C.指针偏左,食盐溶液一定变浓,烧碱潮解 |
| D.指针偏右,食盐溶液一定变浓,烧碱潮解 |
碱溶液中都含有 ,因此不同的碱表现出一些共同的性质。下列关于
,因此不同的碱表现出一些共同的性质。下列关于 性质的描述中不属于碱的共同性质的是( )
性质的描述中不属于碱的共同性质的是( )
| A.能使紫色石蕊试液变蓝色 |
| B.能与盐酸反应生成水 |
| C.能与硫酸钠溶液反应生成硫酸钡沉淀 |
| D.能与二氧化碳反应生成水 |
如图所示,在一个盛有氢氧化钠溶液的容器中有一支燃烧的蜡烛,现用一个杯子将蜡烛罩住,猜想一下,发生的现象是( )
| A.蜡烛燃烧不变,杯子内液面不变 |
| B.火焰逐渐熄灭,杯子内液面下降 |
| C.蜡烛燃烧更旺,杯子内液面上升 |
| D.火焰逐渐熄灭,杯子内液面上升 |
下列有关氢氧化钠性质的说法错误的是( )
| A.氢氧化钠有腐蚀性 |
| B.固体氢氧化钠有挥发性 |
| C.氢氧化钠能吸收二氧化碳而变质 |
| D.固体氢氧化钠能吸收水蒸气而潮解 |
根据下图回答:经数小时后,U形管A、B两处的液面会出现的现象是(实验装置足以维持实验过程中小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
A.A处上升,B处下降
B.A、B两处都下降
C.A处下降,B处上升
D.A、B两处都不变
物质存放在敞口烧杯中一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸
| A.仅①⑥ |
| B.仅②③⑤ |
| C.仅③⑤ |
| D.仅②④⑥ |
如下图所示,在蒸馏烧瓶内加适量石灰石和稀盐酸,经检验产生的气体充满烧瓶时,将一气球紧套在瓶口,气球逐渐胀大.然后打开弹簧夹,将注射器中NaOH溶液注入烧瓶并振荡,气球迅速缩小并被吸入烧瓶内.
(1)检验产生的气体充满烧瓶的操作是________________________.
(2)气球被吸入烧瓶是由于NaOH溶液与瓶内气体反应,使瓶内气压________.该反应的化学方程式为________________________________________.
把一枚生锈的铁钉放入过量的稀盐酸中,首先可观察到的现象是________________,反应的化学方程式为________________;过一段时间后,又观察到铁钉表面有________产生,产生该现象的化学方程式为________________.
硫酸、盐酸是重要的化工原料。
(1)浓硫酸在实验室常用作干燥剂,因为浓硫酸有______性。
(2)写出稀硫酸与下列物质反应的化学方程式:
①与铁粉反应:_________________________________,
②与碳酸钠溶液反应:___________________________,
③与氯化钡溶液反应:____________________________,
上述反应中,属于酸的共同性质的是____________________(填编号)。
(3)盐酸的下列用途中,不能用硫酸代替盐酸的是_______(填编号)。
①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中的少量氢氧化钠
以下是某化学小组探究的过程.
向NaOH溶液中滴入紫色石蕊溶液,溶液呈蓝色.
请在下列横线上填写适当的内容.
[提出问题]是什么粒子使紫色石蕊溶液呈蓝色呢?
[查找资料]NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
[猜想]是大量的OH-使紫色石蕊溶液呈蓝色.
[实验探究步骤及其说明]
(1)在一支干净的试管中加入2mL蒸馏水,再滴入几滴紫色石蕊溶液,紫色石蕊溶液几乎不变色,说明________________________.
(2)在一支干净的试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊溶液,紫色石蕊溶液几乎不变色,说明________________________.
(3)________________________________________________________________________.
[结论]原猜想________.(填“成立”或“不成立”)
酸是一类重要的化合物,它能与许多物质发生化学反应,请将你所学过的有关酸的性质与用途归纳整理,并完成下面的填空.
(1)不反应的是(填序号,下同)________;冒气泡的是________;有浅绿色溶液出现的是________;有黄色溶液出现的是________;有蓝色溶液出现的是________.
(2)根据实验及现象,分析、比较和归纳而得出的结论有(至少答3条):
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________.
(3)指出上述实验中有关物质及反应在实验室、生产和生活等方面的实际应用(答2条):
①________________________________________________________________________;
②________________________________________________________________________.
向微型实验仪器井穴板的4个井穴(已编号1、2、3、4)中分别滴加盐酸、醋酸、硫酸铝和氯化铵(所有试剂用量共约0.8mL),观察到四种溶液均变化。
(1)本实验说明这四种溶液都显________性。
(2)由此实验的过程和现象你还能得出哪些结论。__________________________________.
某些食品的包装袋内,放有装有白色固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”.某同学对一袋久置在空气中的干燥剂进行了探究.
他先取部分久置的干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液.然后对滤液的酸碱性和白色固体的组成作了探究.
[实验探究一]探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显________(填“酸性”“碱性”或“中性”).
[实验探究二]探究白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3.
他查阅有关资料得知:
CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量.氢氧化钙微溶于水.
[分析判断]你认为该白色固体中一定不含有的物质是________.
[实验操作]下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告.
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量白色固体,倒入适量水,充分搅拌、静置; ②向上层清液中滴加无色酚酞溶液 |
上层清液呈现________色 |
白色固体中一定含有氢氧化钙 |
| 另取少量白色固体放入试管中,滴加稀盐酸 |
________ |
白色固体中一定含有碳酸钙 |
[总结反思]
(1)只通过以上实验,还不能证明这袋久置于空气中的干燥剂是否含有CaO.请用化学方程式表示原因________________________________.
(2)请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:________________________________.
氢氧化钠溶液长期暴露在空气中会逐渐变质,这一变化的化学方程式为________________;检验氢氧化钠溶液是否变质,可选用的试剂是________;如果已变质,加入此试剂时发生的现象是________________,有关的化学方程式为________________.
用化学方程式解释下列现象:
小颖同学在探究二氧化碳的性质时,将二氧化碳气体通入紫色石蕊溶液,石蕊溶液很快变红色,原因是________________;课后清洗仪器时,小颖发现变红的石蕊又变回紫色,原因是________.
实验室有盐酸、白醋、柠檬酸三种溶液,回答下列问题:
(1)向三氧化二铁中放入足量盐酸,充分反应后,观察到的现象是________,反应的化学方程式是________________________.
(2)白醋、柠檬酸溶液也能与三氧化二铁发生类似反应,说明白醋、柠檬酸溶液和盐酸中都含有的离子是________.
(3)理论上溶解3.2g三氧化二铁,需要36.5%的盐酸________g.
某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水中很快就变成了蓝色,肥皂水显________(填“酸性”或“碱性”).
(2)该牵牛花的汁液________(填“能”或“不能”)用作指示剂.
(3)将牵牛花泡在家庭厨房里的某种调味品中,牵牛花变成了红色,选用的调味品可能是________.
生活中化学变化广泛存在,小李将一生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_ _____,发生的化学方程式_ ____;反应一段时间后,又观察到的现象是____ __,发生反应的化学方程式为_ _____。
归纳总结是学习化学的重要方法,小李同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。 
(1)为了验证反应①,小李将无色酚酞溶液滴入NaOH液中,溶液变成_______色。
(2)依据反应②说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:____ _____。
(3)小李用微观示意图(右图)来说明反应③的发生,用化学反应方程式表示为:____ _____。从该图可以看出,反应前后没有发生变化的微观粒子有______ _____。 
现有白纸、溶质质量分数分别为:A.10%的NaOH溶液;B.5%的H2SO4溶液;C.5%的紫色石蕊溶液.试设计《“雨”落叶出红花开》的趣味实验:先在白纸上用玻璃棒蘸取________(填字母序号,下同)画出花,洗净后再蘸________画出叶,将白纸挂上墙,将________喷在纸上即可.实验的化学原理是________.
下图是某硫酸试剂瓶标签上的部分文字说明.
(1)取10mL该硫酸可配制成9.8%的硫酸________g.
(2)取适量该硫酸与锌反应可生成SO2气体:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O.反应一段时间后,还可能生成另一种气体,请解释其原因:________________________________
_______________________________________________________________________________
_______________________________________________________________________________
______________________________________________________________________________.
请仔细观察下面溶液的变化并回答问题。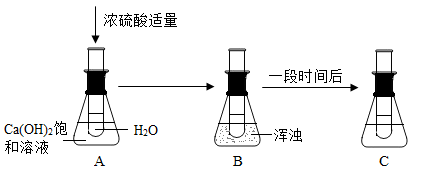
(1)A中的试管________(填“能”或“不能”)把水加入浓硫酸。
(2)B中溶液变浑浊的原因是________________________________.
(3)把A中试管内试剂改为Mg和稀盐酸,_______(填“会”或“不会”)出现与上图相同的现象。
(4)在A、B、C中,氢氧化钙溶液的质量分数的大小关系是___________(用A、B、C和“>”“<”或“=”表示)。
如图所示是小庆同学归纳的几种含钙化合物的知识网络图,请根据该图回答:
(1)属于碱的是_________.
(2)可作仪器干燥剂的是______________________.
(3)写出图中涉及的任意一个化学方程式______________________________________.
如图所示化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是______(填“酸”或“碱”),试剂A的名称是_________.
(2)若X是稀硫酸,B是氧化物,则B的化学式为___________.
(3)若X是稀盐酸。C是单质,则C的名称为_______________.
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为________________________.
化学是一门以实验为基础的科学,化学所取得的丰硕成果与实验的重要作用分不开.结合下列实验仪器回答问题:
(1)写出指定仪器的名称:(A)_______________________;(E)_______________________.
(2)上述仪器中稀释浓硫酸还缺少的玻璃仪器是________________________;稀释浓硫酸的正确操作是________________________;若不慎将少量浓硫酸沾到皮肤上,应立即________________________,然后涂上3%~5%的碳酸氢钠溶液.请写出碳酸氢钠溶液与硫酸反应的化学方程式________________________.
在初三(1)班的化学课上,老师向学生展示了两瓶无标签的溶液,它们分别是稀盐酸和氢氧化钠溶液,要求学生设计实验方案加以区别.
(1)如果你是初三(1)班的学生,你认为可滴加什么试剂加以区别?________________________________.
(2)在实验操作前,老师提醒学生要注意安全,这是因为稀盐酸和氢氧化钠溶液都具有________(填“酸性”“碱性”或“腐蚀性”).
(3)在交流实验方案时,李维同学认为可将CO2气体分别通入这两种溶液,通过观察现象加以区别,但张明同学不赞同李维同学的方案,请说明不赞同的理由.________________________.
化学晚会上小豆把一张白纸的正、反两面向大家展示清楚,然后把白纸用电吹风的热风吹片刻,不一会儿,白纸上出现了一只黑猫,大家惊叹不已.你知道这是怎么回事吗?请你用所学的化学知识来解释.
(1)小豆事先用________画了一只猫.
(2)使白纸出现黑猫的物质是________;该物质具有________性.
同学们利用如下装置验证CO2能与NaOH反应.(装置气密性良好)
(1)打开K1、K3,关闭K2,当D中出现________的现象时,可确定C中收集满CO2.
(2)C中收集满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生了反应.
①小明发现此装置有明显不足,认为应该在________(填装置字母序号)之间增加洗气瓶E,其作用是________.
②改进装置后,小红认为要想证明CO2与NaOH发生反应,还应利用上述装置补充一个对比实验,实验方案是________.
KOH溶液中含有H2O、K+、OH-,能使无色酚酞溶液变成红色.某化学兴趣小组想探究KOH溶液使无色酚酞溶液变成红色的原因.
[提出问题]KOH溶液中的什么成分使无色酚酞溶液变红?
[猜想]猜想1:KOH溶液中的H2O使无色酚酞溶液变红.
猜想2:KOH溶液中的K+使无色酚酞溶液变红.
猜想3:KOH溶液中的________(填化学式)使无色酚酞溶液变红.
[实验探究]
| 实验操作 |
实验现象 |
结论 |
| ①用试管取少量蒸馏水,滴入1~2滴无色酚酞溶液 |
试管内溶液不变色 |
猜想1不成立 |
| ②用试管取少量KCl溶液,滴入1~2滴无色酚酞溶液 |
________ |
猜想2不成立 |
| ③________,滴入1~2滴无色酚酞溶液 |
试管内溶液变红 |
________ |
[讨论反思]有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是________________.
[拓展]①向Ba(OH)2溶液中滴入几滴无色酚酞溶液,观察到的现象是________________________________;
②KOH固体应________保存.
小刚和小丽两位同学用图所示装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.
(1)小刚关闭K,通入二氧化碳,A、B中均无明显变化.B中盛放________溶液.
(2)小刚打开K,继续通入二氧化碳.B中反应的化学方程式为________.
此步的实验目的是________.
小丽认为:通常状况下,1体积水约能溶解1体积的二氧化碳,因此上述实验不足以证明二氧化碳和氢氧化钠发生了反应.
(3)小丽用洗涤干净的上述装置重新做实验,分别量取50mL上述溶液放入A、B中,关闭K,通入约500mL二氧化碳,A、B中均无明显变化.此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是________.
小王同学在做某次化学实验时,进行了如下图所示的步骤:将稀盐酸滴入盛有20g氢氧化钠溶液(滴有2滴酚酞溶液)的烧杯中,恰好完全反应时,消耗此稀盐酸的质量为10g。 
回答并计算:
(1)当实验恰好完全反应时。烧杯中现象是___________________。
(2)求此NaOH溶液中溶质的质量。
(3)求所得溶液中溶质的质量分数(酚酞试液质量不计)。
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
(1)用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具有________性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其________性.
(2)探究浓硫酸的吸水性.兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析.根据室温环境下实验的数据绘成的曲线如下图:
① 释浓硫酸时,应将________缓缓地注入盛有________的烧杯中并不断搅拌.
②由下图曲线你能得到的实验结论有哪些?(写两点)
________________________________________________________________________;
________________________________________________________________________.
(3)探究浓硫酸能否使铁钝化(钝化指在表面形成氧化膜保护层,使内层金属不再发生变化).
可选用的实验药品有:相同铁片若干、浓硫酸、稀硫酸、硫酸铜溶液等.实验仪器任选.
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整.
| 方案 |
实验 假设 |
实验方案 |
实验现象 与结论 |
| Ⅰ |
能发生钝化 |
取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中 |
无明显变化,假设成立 |
| Ⅱ |
能发生钝化 |
取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中 |
________,假设成立 |
你认为方案Ⅱ与方案I相比,方案Ⅱ的优点是
________________________________________________________________________.
②请你选用提供的药品再设计一个实验,简述实验方案________________________________.
③某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明:________________________
________________________________________________________________________.
物质的性质和用途是化学的重要研究内容.
(1)浓硫酸有吸水性,在实验室中常用它作________剂.
(2)用石灰浆粉刷墙壁,干燥后墙面就变硬了,用化学原理解释该现象.
(3)下图中,用滤纸做成的小花喷洒某溶液后放在烧杯上方,片刻后变成红色.请推测喷洒液和烧杯中溶液可能是什么?(写出一组即可)
盐酸中的溶质是_________,纯净的盐酸是_____色、有______气味的液体,浓盐酸在空气中会生成白雾,原因是_____________________________________________.
硫酸、盐酸是重要的化工原料。
(1)浓硫酸在实验室常用作干燥剂,因为浓硫酸有______性。
(2)写出稀硫酸与下列物质反应的化学方程式:
①与铁粉反应:_____________________________________________.;
②与碳酸钠溶液反应:_______________________________________;
③与氯化钡溶液反应:_______________________________________;
上述反应中,属于酸的共同性质的是____________________(填编号)。
(3)盐酸的下列用途中,不能用硫酸代替盐酸的是________(填编号)。
①金属表面除锈 ②制造药物氯化锌 ③除去NaCl中的少量NaOH
实验室中常需要使用硫酸.
(1)用小木棍蘸少量浓硫酸,放置一会儿后,可观察到________.
(2)98%的浓硫酸稀释为稀硫酸时,一定要将________沿烧杯壁缓慢地注入盛有________的烧杯里,并用________搅拌,此时若用手轻轻触碰烧杯外壁,有________的感觉.
(3)49g质量分数为20%的稀硫酸与足量锌反应,最多生成氢气的质量是多少?(写出计算过程)
下图是稀释浓硫酸实验的示意图.
(1)写出图中a、b两种仪器的名称:a.________、b.________.
(2)b容器所盛的试剂是________(填“水”或“浓硫酸”).
(3)稀释时,若两种试剂添加顺序颠倒,将会________________________________________________________________________.
(4)据媒体报道,有一村民在家里误将装在酒瓶中的稀硫酸当成白酒喝下,结果造成食道和胃的严重损伤.这是因为稀硫酸具有________.这一事件警示我们,家中存放或使用药品时应注意________________________________________________.
化学小组的同学探究二氧化碳与氢氧化钠的反应.实验方案如下:
| 实验装置 |
实验步骤及操作 |
实验现象 |
 |
①将注射器1中的溶液推入充有CO2的瓶中 |
气球鼓起 |
| ②…… |
无明显现象 |
|
| ③将注射器2中的溶液推入瓶中 |
溶液中有气泡产生,气球变瘪 |
|
| ④向外拉注射器3 |
澄清石灰水变浑浊 |
(1)步骤①中气球鼓起的原因可能是____________________________________________
________________________________________________________________________.
(2)步骤②中的操作是________________________,其目的是________________________.
(3)步骤④中发生反应的化学方程式为________________________________________
________________________________________________________________________.
(4)本实验的结论是________________________________________________________.
实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究.
假设1:只含KOH;假设2:含KOH和K2CO3;假设3:只含K2CO3.
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________.
(2)取少量样品于试管中,加入足量稀盐酸,观察到________________________,说明假设2或假设3成立.
(3)进一步探究的过程如下:
①“操作1”的名称是________.
②“固体A”的化学式是________.
③加入足量CaCl2溶液的作用是________________________________________________
________________________________________________________________________.
(4)变质试剂也有利用价值,从KOH和K2CO3的组成和性质看,这瓶变质试剂的用途是____________________________________________________________________(写出一条).
王奇在学习了碱的化学性质后,了解到碱溶液可使无色酚酞溶液变红色.王奇很善于动脑,他想动手探究氢氧化钠溶液(含H2O、Na+、OH-)中哪一种粒子可使酚酞变红色.请你一起来探究:
实验步骤:
(1)在第一支试管中加入约2mL蒸馏水,滴入几滴酚酞溶液,观察现象.
(2)在第二支试管中加入约2mL NaCl溶液,滴入几滴酚酞溶液,观察现象.
(3)在第三支试管中加入约2mL NaOH溶液,滴入几滴酚酞溶液,观察现象.
通过上述实验的探究,回答下列问题(其中“现象”是指无色酚酞溶液是否变红):
实验(1)看到的现象是________________________,你得出的结论是________________________________.
实验(2)看到的现象是________________________________________________________,
说明Na+____________________________________________________________________.
实验(3)看到的现象是________________________________,你得出的结论是________________________________________.
二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(I)和(III)中的小花变红,(II)中的小花不变色。
【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验不足以证明“二氧化硫和水反应生成了酸”。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
| 实验操作 |
实验现象 |
| __________________ |
__________________ |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式:_____________________________________________.
盐酸中含有 分子、
分子、 离子,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。
离子,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。
| |
滴加紫色石蕊溶液后的现象 |
结论 |
| 第1孔 |
孔中溶液仍为紫色 |
水分子________ |
| 第2孔 |
|
|
| 第3孔 第4孔 |
|
|














 .
.














 粤公网安备 44130202000953号
粤公网安备 44130202000953号