江苏省苏州市九年级上学期期末模拟化学试卷
人们学习和研究化学,都是希望化学给人们带来正能量,但是在生活中常有些不法分子不是利用化学来造福人类,而是危害人类,下列做法严重危害人类的是
| A.利用化学合成各种药品治疗疾病 |
| B.研制各种化肥用于种植庄稼 |
| C.用SO2漂白已霉变的食品,使其颜色好看 |
| D.在月饼包装盒内放置CaO干燥包 |
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图。下列有关镓的说法错误的是
| A.原子的核电荷数是31 | B.元素符号是Ga |
| C.属于金属元素 | D.相对原子质量为69.72g |
下列物质的用途与其化学性质相关的是
| A.用铝做导线 | B.干冰用于人工降雨 |
| C.用活性炭来净化水 | D.用氮气做食品包装袋的填充气 |
下图是某个化学反应的微观模拟图,下列关于该反应前、后的说法正确的是
| A.均为混合物 | B.质量减少 |
| C.原子总数减少 | D.分子总数不变 |
实验室中利用过氧化氢、氯酸钾、高锰酸钾都可以制取氧气,其原因是
| A.都属于氧化物 | B.都含有氧气 |
| C.都含有氧气分子 | D.都含有氧元素 |
20世纪60年代,就有人预言可能存在由4个氧原子构成的氧分子(O4),但一直没有得到证实.最近,意大利的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它的存在.下列叙述中正确的是
| A.O4是一种新型的化合物 | B.一个O4分子中含有2个O2分子 |
| C.O4和O2的性质完全相同 | D.O4和O2混合后形成的是混合物 |
现有X、Y、Z三种金属,只有X能与稀盐酸反应;Z能从Y的化合物溶液中将Y置换出来,则三种金属的活动性由强到弱的顺序是
| A.X、Z、Y | B.Z、Y、X | C.X、Y、Z | D.Y、Z、X |
下列关于四种粒子的结构示意图的说法中正确的是
| A.①③属于不同种元素 |
| B.④属于离子,离子符号为Mg+2 |
| C.②③的化学性质相似 |
| D.②表示的元素在化合物中通常显+1价 |
若金属锰在金属活动性顺序中位于铝和锌之间,则下列反应不能发生的是【提示:MnSO4溶于水】
| A.Mn+2HCl =MnCl2+H2↑ |
| B.Fe + MnSO4=FeSO4 + Mn |
| C.2Al+ 3MnSO4=Al2(SO4)3 + 3Mn |
| D.Mg + MnSO4=MgSO4 + Mn |
下表中对一些事实的解释正确的是
| |
事实 |
解释 |
| A |
活性炭净水 |
活性炭疏松多孔,有很强的吸附能力 |
| B |
CO和CO2的性质不同 |
CO2比CO中的氧原子多 |
| C |
将铝丝浸入硫酸铜溶液中,铝丝表面无明显现象 |
铜比铝活泼 |
| D |
25m3的氧气可以转入0.024m3的钢瓶中 |
氧气分子的体积变小 |
小王同学需配制100g 12%的NaOH溶液来制作“叶脉书签”。在配制溶液过程中,下列做法正确的是
| A.在托盘上垫上纸并称取12g NaOH固体 |
| B.称量时发现指针向右偏转,应调节游码使天平平衡 |
| C.用100mL量简量取88mL水 |
| D.把称取的NaOH固体直接倒入装有88mL水的量筒中溶解 |
T0C时,将一定量的生石灰放入饱和的石灰水中,搅拌,并冷却到原温度,得到的溶液与原溶液相比,下列物理量前后不变化的是
①溶质质量 ②溶剂质量 ③溶液质量 ④溶质质量分数 ⑤溶解度
| A.①③⑤ | B.②④⑤ | C.②④ | D.④⑤ |
某元素R的原子序数为m,能够形成核外有x个电子的Rn+ 离子,则下列关系式一定正确的是
| A.m = n | B.m =" n" + x | C.m =" n" - x | D.m =" x" – n |
20℃时,取四份一定质量的饱和硝酸钾溶液进行如下实验后,所得结论正确的是( )
| A.保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大 |
| B.保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大 |
| C.保持温度不变,加入10g溶剂后,溶质的溶解度减小 |
| D.降温至10℃后,溶质的溶解度减小 |
将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量反应时间的关系如图所示,下列说法错误的是
| A.反应结束后镁一定有剩余 |
| B.反应消耗盐酸的总质量一定相等 |
| C.0﹣t1时段,产生氢气的质量镁比铁大 |
| D.0﹣t2时段,参加反应的镁的质量与铁相等 |
根据化学方程式不能获得的信息是
| A.该反应中的反应物和生成物 | B.化学反应的快慢 |
| C.反应发生所需要的条件 | D.参加反应的各粒子的相对数量 |
实验室里,用如右图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是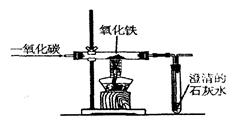
| A.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 |
| B.实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 |
| C.反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 |
| D.为了减少空气污染,应增加尾气处理装置 |
甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中正确的是
| A.甲的溶解度比乙大 |
| B.t1℃时,甲的饱和溶液中溶质与溶液的质量比为1:5 |
| C.t2℃时,甲、乙两种饱和溶液中溶质的质量分数相等 |
| D.将等质量甲、乙的两种溶液分别由t3℃降温至t2℃,析出甲的质量一定比析出乙的质量大 |
大蒜中含有的一种有效成分“硫化丙烯”(C3H6S)具有一定的杀菌食疗作用。下列有关硫化丙烯的说法正确的是
| A.硫化丙烯的相对分子质量为74 |
| B.硫化丙烯中硫元素的质量分数最大 |
| C.硫化丙烯分子中碳、氢、硫元素质量比为3:6:1 |
| D.硫化丙烯由3个碳原子、6个氢原子和1个硫原子构成 |
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是
| A.反应后物质M的质量为13g | B.物质Q可能是该反应的催化剂 |
| C.反应中N、P的质量比为5:4 | D.该变化的基本反应类型是分解反应 |
暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置见如图).以下对此改进实验的叙述,错误的是
| A.此实验的原理是利用铁生锈消耗氧气 |
| B.实验前一定要检查装置的气密性 |
| C.此实验中发热剂的多少不影响测量结果 |
| D.此实验测出氧气的体积分数约是18.3% |
(1)用化学符号表示下列粒子
①2个氢原子______ ②3个氧原子构成的臭氧分子______
(2)某化学反应的微观示意图,如图所示
①反应物中一种化合物,化学式为_____
②生成物中有_____种氧化物
③反应物中未完全反应的物质的名称________
写出下列化学方程式:
(1)实验室用高锰酸钾制取氧气_________________________
(2)高温下一氧化碳还原氧化铁_________________________
(3)将氯化氢和氨气两种无色气体混合,生成氯化铵固体_________________________
(4)加热碱式碳酸铜 __________________________
(9分)实验室提供了下图所示的仪器。回答下列问题:
(1)写出图中标示仪器的名称:A ,F_________________________
(2)用大理石和稀盐酸反应制取二氧化碳,应选用的仪器是 (填写字母序号),药品加入的先后顺序是 .实验中要节约药品,如果没有说明药品的取用量,一般应取用 。
(3)用高锰酸钾制取氧气,采用排水集气法收集氧气时,发现水槽中的水变红了,可能的原因是 ;采用向上排空气法收集气体时,验满的方法是 .
(4)用过氧化氢溶液和二氧化锰制取氧气,发生反应的化学方程式为 ,
该反应属于 反应______(填写基本反应类型).
如图甲是A、B、C三种固体物质的溶解度曲线图.
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 ,P点所表示的含义为 .
(2)①将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时三种物质的溶质质量分数由大到小的顺序是 ;②如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种?
(3)t℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法有: 、 (写两种方法)
常温下M、N、P、Q是四种常见的无色气体,它们之间转化关系如图所示(图中反应条件已省略,X在常温下为无色液体),请回答以下问题:
(1)写出下列物质的化学式
M ;N ;P ;Q ;
(2)CH4与M反应的化学方程式 ;该反应属于 (填“放热”或“吸热”)反应.
(4分) 煤是目前人类使用的最主要燃料。工业上,煤炭燃烧前进行粉碎的目的是增大煤与空气(或氧气)的接触面积。煤隔绝空气加强热得到的焦炭,是冶铁的重要原料。为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应)。
方案I 取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣.则赤铁矿粉中氧化铁的质量分数为 .
方案Ⅱ如图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应.测得氢氧化钠溶液反应前后质量增加了1.32g.如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3 4Fe+3CO2计算,赤铁矿粉中氧化铁的质量分数为 .
4Fe+3CO2计算,赤铁矿粉中氧化铁的质量分数为 .
【实验反思】方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,
这会导致测出的氧化铁的质量分数 (选填“偏大”、“偏小”或“不变”).
【实验分析】方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是____(写出一种即可).

 粤公网安备 44130202000953号
粤公网安备 44130202000953号