江西省德镇市高二上学期期末化学试卷
未来新能源的特点是资源丰富,在使用 时对环境无污染或者污染很小,且可以再生.下列属于未来新能源标准的是
①天然气 ② 生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
| A.①②③④ | B.②③⑤⑦⑧ | C.⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)  2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是
| A.v(H2)=0.1 mol/(L·s) | B.v(N2)=0.1 mol/(L·s) |
| C.v(N2)=0.2 mol/(L·s) | D.v(NH3)=0.3 mol/(L·s) |
①pH=0的盐酸 ②0.5 mol·L-1的盐酸 ③0.1 mol·L-1的NH4Cl溶液 ④0.1 mol·L-1的NaOH溶液 ⑤0.5 mol·L-1的NH4Cl溶液,以上溶液中水电离出的c(H+)由大到小的顺序是
| A.⑤③④②① | B.①②③⑤④ | C.①②③④⑤ | D.⑤③④①② |
下列叙述正确的是:①锌跟足量稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量 ②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③电镀时,应把镀件置于电解槽的阴极 ④冶炼铝时,可以电解熔融态的AlCl3 ⑤钢铁表面常易锈蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.③⑤ | D.②④ |
据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
| A.该星球表面温度很高 | B.该星球表面温度很低 |
| C.该反应为放热反应 | D.高温下稳定性CH2=CHOH>CH3CHO |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)==="2CO(g)" ΔH=b, 则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.化学反应速率的关系是2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.达到化学平衡时4v正(O2)=5v逆(NO) |
在一密闭容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:2R(g)+5Q(g) 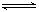 4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
常温下在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Fe2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.能与Al反应产生H2的溶液:K+、Na+、Clˉ、NO3ˉ |
关于下列装置说法正确的是
| A.装置①中,盐桥中的Cl-移向ZnSO4溶液 |
| B.装置②工作一段时间后,b极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 |
Zn(OH)2 |
ZnS |
AgCl |
Ag2S |
MgCO3 |
Mg(OH)2 |
| 溶度积 |
5×10-17 |
2.5×10-22 |
1.8×10-10 |
6.3×10-50 |
6.8×10-6 |
1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是
A.2AgCl+Na2S===2NaCl+Ag2S
B.MgCO3+H2O Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
C.ZnS+2H2O===Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
| A.阴极产物是氢气 | B.阳极产物是氧气 |
| C.阴极产物是铝和氧气 | D.阳极产物只有氯气 |
将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为
| A.4.48 L | B.5.6 L | C.6.72 L | D.7.8 L |
下列溶液中有关物质的量浓度关系错误的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为(填序号) 。
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(共9分)如图所示三套实验装置,分别回答下列问题。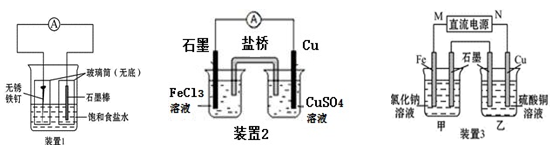
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为_____________________________。
(2)装置2中的铜是______极(填“正”或“负”),该装置中石墨电极所发生的反应为_______________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①甲烧杯中铁为_____极;甲烧杯中石墨电极的电极反应式为____________________
②乙烧杯中电解反应的离子方程式为_________________________________________
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在标准状况下的体积为________ mL 。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是 。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)容积一定,下列情况不能说明该反应一定达到平衡的是 。
A.混合气体的平均平均相对分子质量不变
B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol H—O键
D.混合气体中c (CO2) : c (H2) =" 1" : 3
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH (g)的浓度随时间变化如图2所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1, CO2和H2的转化率比是 :
(5)下列措施中能使(4)题中n(CH3OH)/n(CO2)增大的 有 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1molCO2和3molH2
(6)若在另一个密闭容器中充入1molCO2和3molH2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数________(4)题中的CO2的体积百分数。(“>”或“<”或“=”,下同)
某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用 (填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是 ,(如有几种,可任填一种)滴定终点的现象是 。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
20.00 |
24.01 |
| 2 |
20.00 |
23.99 |
| 3 |
20.00 |
22.10 |
计算样品中,NaOH的质量百分含量为 。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
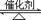 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是
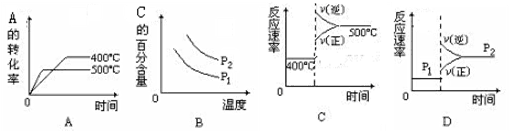
 2NH3(g)
2NH3(g) 粤公网安备 44130202000953号
粤公网安备 44130202000953号