北京市朝阳区高一上学期期末考试化学试卷
下列过程不涉及化学变化的是
| A.赤铁矿石炼铁 | B.氢氟酸刻蚀玻璃 |
| C.液氨制冷 | D.自然界中氮的固定 |
下列关于NaCl的说法不正确的是
| A.给NaCl溶液通电,使NaCl发生电离 |
| B.NaCl是电解质 |
| C.NaCl电离的方程式是:NaCl== Na+ +Cl- |
| D.NaCl溶液能导电,是因为溶液中有自由移动的离子 |
下列做法会对人体健康造成较大危害的是
| A.用大量SO2漂白银耳 |
| B.用小苏打(NaHCO3)焙制糕点 |
| C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
下列说法中,不正确的是
| A.常温下可用铁制容器盛装浓硝酸 | B.氧化铁常用作红色油漆和涂料 |
| C.硅胶常用作食品、药品干燥剂 | D.生石灰可用作食品的抗氧化剂 |
向下列各物质的水溶液中滴加稀H2SO4或MgCl2溶液时,均有白色沉淀生成的是
| A.BaCl2 | B.Na2CO3 | C.KOH | D.Ba(OH)2 |
下列叙述不正确的是
| A |
B |
C |
D |
 |
 |
  |
 |
| 用酒精萃取碘水中的碘 |
烧杯中的Fe(OH)3胶体可产生丁达尔效应 |
蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 |
Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
关于钠及其氧化物性质的叙述中,正确的是
| A.Na能与CuSO4溶液反应置换出红色的铜 |
| B.Na2O是碱性氧化物,与酸反应生成盐和水 |
| C.Na2O和Na2O2都能与水反应,生成物完全相同 |
| D.Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
检验氯化氢气体中是否混有氯气,不可采用的方法是
| A.用湿润的有色布条 | B.用湿润的蓝色石蕊试纸 |
| C.将气体通入硝酸银溶液 | D.用湿润的淀粉碘化钾试纸 |
用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是
下列说法正确的是
① Al和Fe可用于做建筑材料,也可用于制作饮料罐
② Al和Fe表面在空气中都可自然生成一层致密的氧化膜,保护内层金属不被腐蚀
③Al2O3和Fe2O3都为碱性氧化物,所以都能溶于硫酸
④ Al(OH)3与Fe(OH)3加热都会分解,生成对应的氧化物
| A.①② | B.②③ | C.①④ | D.③④ |
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓盐酸 |
无明显变化 |
| B |
浓硫酸 |
浓氨水 |
冒白烟 |
| C |
酚酞溶液 |
浓氨水 |
溶液变红 |
| D |
氯化铝溶液 |
浓氨水 |
出现白色沉淀 |
解释下列事实的方程式不正确的是
| A.Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2+ 3H2↑ |
| B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32-+ H2O |
C.热的浓NaOH溶液与NH4Cl液混合产生气体:NH4++ OH- NH3↑+ H2O NH3↑+ H2O |
D.红热的Fe丝与水接触,表面形成蓝黑色保护层:2Fe + 3H2O(g)  Fe2O3 +3H2↑ Fe2O3 +3H2↑ |
NA表示阿伏伽德罗常数。下列叙述中正确的是
| A.标准状况下,22.4 L CCl4中含CCl4分子数为NA |
| B.4.0 g NaOH固体溶于100 mL水中,得到1 mol/L的 NaOH溶液 |
| C.常温常压,5.6 g Fe在足量Cl2中燃烧,转移的电子数为0.3NA |
| D.分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为4NA |
某同学用下图所示的装置及药品进行比较酸性强弱的实验,一段时间后试管②中有胶冻状物质生成。下列说法正确的是
| A.向Na2SiO3溶液中滴入酚酞溶液无明显现象 |
| B.试管①中反应的离子方程式是:Na2CO3+ 2H+ ="=" 2Na+ + CO2↑+ H2O |
| C.该实验可以证明酸性:盐酸>碳酸>硅酸 |
| D.若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸 |
要证明CuSO4溶液显蓝色不是由于SO42-造成的,下列实验无意义的是
| A.观察K2SO4溶液的颜色 |
| B.加水稀释CuSO4溶液,溶液颜色变浅 |
| C.向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色 |
| D.向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色 |
下列实验事实得出的结论不正确的是
| 选项 |
实验事实 |
结论 |
| A |
H2可在Cl2中燃烧 |
燃烧不一定有氧气参加 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
氧化铝熔点高于铝 |
| C |
将SO2通入含HClO的溶液中,生成H2SO4 |
HClO酸性比H2SO4强 |
| D |
向FeCl2溶液中滴入KSCN溶液,在液面出现微红色 |
Fe2+在空气中被氧化 |
某抗酸药的有效成分是碱式碳酸镁铝[AlMg3(OH)7CO3],将碱式碳酸镁铝溶于过量盐酸中,产生无色气体A和无色溶液B。下列说法不正确的是
A.A为CO2
B.AlMg3(OH)7CO3与盐酸的反应属于复分解反应
C.AlMg3(OH)7CO3与消耗的H+的物质的量之比为1:9
D.向溶液B中逐滴加入NaOH溶液至过量,产生的白色沉淀最终完全溶解
粗盐中含有不溶性泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等。精制食盐水的实验操作顺序如下:①加入过量BaCl2溶液,②加入过量NaOH溶液,③加入过量Na2CO3溶液,④加入适量盐酸,⑤过滤。下列说法不正确的是
| A.①②③中加入过量的试剂是为了完全除去相应的杂质离子 |
| B.③中加入过量Na2CO3溶液仅为了完全除去Ca2+ |
| C.因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好 |
| D.④中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量” |
H2O2是重要的化工原料。
(1)H2O2中O元素的化合价为______。
(2)①向酸性KMnO4溶液中滴加H2O2溶液,溶液褪色,体现了H2O2的还原性,其中氧化过程是:H2O2→______(填化学式)。
②向H2SO4酸化的FeSO4溶液中滴加H2O2溶液,溶液变成黄色,体现了H2O2的氧化性,反应的离子方程式是_________。
(3)H2O2不稳定易分解。实验室需要448 mL O2(标准状况),则理论上最少需要用30%的H2O2溶液(密度为1.10 g/mL)_______mL。(计算结果保留一位小数)
电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:
(2)I中加入过量Fe粉 ,然后过滤,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是HCl。.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl3•6H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 。
(2)试剂A是 。
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是 。
a.检验Cl2的存在 b检验Fe3+的存在 c.检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是 (填字母)。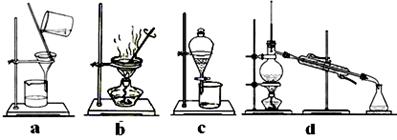
下图为氮及其化合物的类别与化合价对应的关系图。
(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2  2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
| 实验序号 |
实验步骤(内容) |
现象 |
| ① |
在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观。 |
|
| ② |
分别滴入几滴水,振荡,摸试管底部。 |
试管 放热现象更明显(填“a”或“b”)。 |
| ③ |
继续向两试管中分别加入10.0 mL水,用力振荡,观察现象。 |
|
| ④ |
再分别向两试管中滴加2滴酚酞溶液,观察现象。 |
溶液均变红,颜色较深的试管是_________(填“a”或“b”)。 |
| ⑤ |
最后分别向两溶液中滴加足量盐酸。 |
红色褪去,均有无色气体产生。经计算生成气体的量a_____b(填“>”“<”或“=”)。 |
| ⑥ |
加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)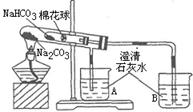 |
|
(1)请帮助该小组同学完成实验报告中的内容。
(2)已知:20℃时Na2CO3的溶解度为20.5 g。由实验 (填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5 g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是 ,化学方程式是 。
(3)由实验⑥可以得出的结论是 ,用化学方程式说明得出结论的原因 。
下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
|

(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是 。
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| |
加入试剂 |
现象 |
反应的离子方程式 |
| 第一份 |
加入NaOH溶液 |
有白色沉淀生成 |
____________ |
| 第二份 |
加入氯水 |
有白色沉淀生成 |
____________ |
完成上述反应的离子方程式。
(4)④中棉花团的作用是 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是 。
氯气及其相关产品在生活、生产中应用广泛。
(1)氯气属于有毒气体,在实验室进行相关实验时,除必须进行尾气处理外,还应注意的问题是 ;若在生活中遇贮氯罐意外泄漏,应 (填“顺风”或“逆风”)疏散,消防员喷洒稀NaOH溶液的作用是 。(用化学方程式表示)
(2)① 实验室常用NaOH溶液吸收多余的氯气,下列试剂也可用于吸收氯气的是 (填字母)。
a. NaCl溶液 b. FeSO4溶液 c. Na2SO3溶液
② 写出①中你选择的吸收试剂与Cl2反应的离子方程式: 。
(3)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
①分析“对金属制品有腐蚀作用”的原因 。
②需“密闭保存”的原因 。
③“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式: 。
(4)若空气中氯气的含量超过0.1 mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗了0.001 mol/L的KI溶液 100 mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号