高二化学第十八套(甘肃选修四)
下列微粒对CH3COO- + H2O CH3COOH + OH-水解平衡有影响的是( )
CH3COOH + OH-水解平衡有影响的是( )
| A.H3O+ | B. |
C.NO3- | D.Ba2+ |
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
下列说法正确的是( )
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
从起始状态下A出发,在一定条件下可发生一系列变化,由图判断下列关系错误的是( )

A.A D, △H= - △H4 D, △H= - △H4 |
| B.△H1 + △H2 + △H3 + △H4 ="0" |
C.A C, △H=△H3 + △H4 C, △H=△H3 + △H4 |
| D.∣△H2 + △H3∣=∣△H1 + △H4∣ |
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)==Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法中正确的是( )

| A.ΔH<0 ΔS<0 | B.ΔH>0 ΔS<0 |
| C.ΔH<0 ΔS>0 | D.ΔH>0 ΔS>0 |
某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是( )
A.H2Y的电离方程式:H2Y 2H+ +Y2- 2H+ +Y2- |
B.HY-的水解方程式:HY- + H2O H3O+ + Y2- H3O+ + Y2- |
| C.该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+) |
| D.该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
在密闭容器里,A与B反应生成C,其反应速率分别用 、
、 、
、 表示,已知2
表示,已知2 =3
=3 、3
、3 =2
=2 ,则此反应可表示为( )
,则此反应可表示为( )
| A.2A+3B=2C | B.A+3B=2C | C.3A+B=2C | D.A+B=C |
下面是用盐酸滴定氢氧化钠的实验叙述:
①实验中的锥形瓶、滴定管都需润洗。
②滴定前锥形瓶中有水将使滴定结果偏小。
③加入2-3滴酚酞作指示剂。
④滴定时,左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶,眼睛注视锥形瓶中颜色的变化。
⑤滴定一旦发现溶液从红色变成无色,立即停止滴定。
⑥滴定终了时溶液的pH值刚好为7。
⑦若滴定前平视,滴定终点俯视,使结果偏小。
上述相关说法中错误的是( )
| A.①②④⑤ | B.①②⑤⑦ | C.①②⑤⑥ | D.②⑤⑥⑦ |
下列溶液一定呈中性的是( )
| A.c(H+)=c(OH-)=10-6mol/L的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
下列操作正确的是( )
| A.用pH试纸测得某新制氯水的pH值为3.5 |
| B.用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用待测溶液润洗锥形瓶 |
| C.用酸式滴定管量取酸性高锰酸钾溶液5.10mL |
| D.用10mL的量筒量取8.05mL浓硫酸 |
下列叙述中错误的是( )
| A.电解池是电能转化为化学能的装置 |
| B.原电池跟电解池连接后,电子从原电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
知:①2C(s)+O2(g) = 2CO(g)  H= -221.0kJ/mmol
H= -221.0kJ/mmol
②2H2(g) + O2(g) =2H2O(g)  H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应C(s) +H2O(g) = CO(g) + H2(g)的 H为( )
H为( )
| A.+262.6kJ/mol | B.-131.3kJ/mol |
| C.-352.3kJ/mol | D.+131.3kJ/mol |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是( )
| A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
| D.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深 |
| D.工业合成氨反应中加压有利于提高氨气的产率 |
下列叙述正确的是( )
| A.纯锌与硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 |
| B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH- +6e-=CO2 +5H2O |
| C.在铁件上镀铜时,金属铜作阴极 |
| D.电解精炼铜时电解质溶液中铜离子浓度保持不变 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A.V3>V2=V1 | B.V3=V2=V1 | C.V3>V2>V1 | D.V1=V2>V3 |
下列用来表示物质变化的化学用语中,正确的是( )
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- – 2e-= Cl2 |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-= 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu – 2e-= Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe – 2e- = Fe2+ |
关于下列装置说法正确的是( )

| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )

| A.电子通过外电路从b极流向a极 |
| B.每转移0.1mol电子,消耗1.12L的H2 |
| C.b极上的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| D.H+由a极通过固体酸膜电解质传递到b极 |
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+) >c(CH3COO-) >c(H+)>c(OH-) |
| C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D.常温下,某溶液中有水电离出的c(H+)=10-51mol·L-1,则此溶液可能是盐酸 |
体积完全相同的恒容容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,在相同温度下反应达到平衡时A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两容器中SO2转化率的关系正确的是( )
A.a%>b% B.a%=b% C.a%<b% D.2a% = b%
已知反应2HI(g)  H2(g)+I2(g); △H>0,在某一密闭容器中,充入一定量的HI气体,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )
H2(g)+I2(g); △H>0,在某一密闭容器中,充入一定量的HI气体,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )

可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是( )
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是( )

| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,P2>P1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是

②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
已知2A2(g) + B2(g) 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a b(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度 w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:
(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是 。
a.ν(C)=2ν(B2) b.容器内压强保持不变
c.ν(A2) (逆) =ν(B2) (正) d.容器内的密度保持不变
有下图所示装置:
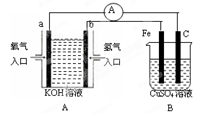
(1)装置A中b为 极,电极反应式为 ,a极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为12.8g时,a极上消耗O2在标准状况下的体积为 L。
(4)若将装置B中的CuSO4溶液更换为100mL滴有酚酞的饱和NaCl溶液,电解一段时间后 极附近颜色变红,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):______ ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO3-)变化趋势可能是:
①逐渐减小;
②逐渐增大;
③先逐渐增大,而后减小;
④先逐渐减小,而后增大。
4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是 。
(4)已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+c(CO32-)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号