江苏省连云港市赣榆县海头高中高三上学期期中化学试卷
化学与技术、社会和环境密切相关。下列说法错误的是
| A.利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| B.采取“燃煤固硫”、“汽车尾气催化净化”等方法,提高空气质量 |
| C.充分开发利用天然纤维,停止使用各种化学合成材料 |
| D.加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率 |
下列有关化学用语表示正确的是
| A.Cl-的电子排布式:1s22s22p63s23p6 |
B.NaCl的电子式为: |
C.硫离子的结构示意图: |
D.中子数为146的铀(U)原子 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.c(Fe3+)=0.1mol·Lˉ1的溶液中:Na+、NH4+、I-、SO42- |
| B.加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| C.0.1mol·Lˉ1NaHCO3溶液中:K+、Ca2+、OH-、Cl- |
| D.澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
对下列物质用途的解释不正确的是
| |
用途 |
解释 |
| A |
明矾可用于净水 |
明矾在水中生成的氢氧化铝胶体有吸附性 |
| B |
SO2可用于漂白纸浆 |
SO2具有氧化性 |
| C |
小苏打可作糕点的膨松剂 |
受热能分解产生CO2气体 |
| D |
A1、Fe制容器储存、运输浓硝酸 |
浓硝酸具有强氧化性,遇铁铝发生钝化 |
用下列实验装置和方法进行相应实验,能达到实验目的的是 
| A.图1所示装置:用苯萃取溴水中的Br2 |
| B.图2所示的装置:向容量瓶中转移液体 |
| C.图3所示的装置:制备少量氨气 |
| D.图4所示的装置:制蒸馏水 |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.6.72 L Cl2与足量的水反应转移的电子数为0.3NA |
| B.1 L 0.5 mol·L-1的氨水中所含的离子和分子总数为0.5NA |
| C.常温常压下,4.6g NO2和N2O4混合物中含有的原子总数为0.3 NA |
| D.在反应KIO3+6HI =KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
下列表示对应化学反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
| B.铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
| C.少量的CO2 通入氨水中:CO2+NH3·H2O=NH4++HCO3- |
| D.用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
下列物质的转化在给定条件下能实现的是
①
②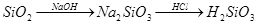
③
④
⑤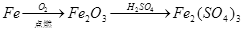
| A.①④ | B.②③ | C.②④ | D.③⑤ |
下列各组中的X和Y两种原子,化学性质一定相似的是
| A.X原子和Y原子最外层都只有一个电子 |
| B.X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2 |
| C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 |
| D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子 |
U的常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解:[UO2(NO3)2]→UxOy+NO2↑+O2↑(未配平)。将气体产物收集于试管中并倒扣于盛有水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物的化学式是
| A.UO2 | B.UO3 | C.2UO2·UO3 | D.UO2·2UO3 |
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征。下列各对粒子中,空间结构相似的是
| A.CS2与NO2 | B.CO2与N2O | C.SO2与O3 | D.PCl3与BF3 |
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OH- Fe3O4+S4O62-+2H2O。下列说法正确的是
Fe3O4+S4O62-+2H2O。下列说法正确的是
| A.O2是氧化剂,S2O32-和Fe2+是还原剂 |
| B.每生成1 mol Fe3O4,则转移电子数为2 mol |
| C.参加反应的氧化剂与还原剂的物质的量之比为1:2 |
| D.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
下列实验操作、现象与实验结论一致的是
| 选项 |
实验操作、现象 |
实验结论 |
| A |
向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,再加入稀盐酸沉淀不消失 |
该溶液中含有SO42- |
| B |
用铂丝蘸取某溶液进行焰色反应, 火焰呈黄色 |
该溶液中一定含有Na+, |
| C |
将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变为黄色 |
H2O2的氧化性比Fe3+强 |
| D |
向溶液中加入新制氯水,再加几滴KSCN溶液溶液变红 |
该溶液中一定含有Fe2+ |
在隔绝空气的情况下,9.2 g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48 L(标准状况下)NO气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为
| A.18.6 g | B.20 g | C.19.4 g | D.24 g |
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断正确的是(不计CO2溶解)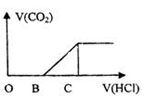
| A.若OB=0,则溶液M为Na2CO3溶液 |
B.若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2 HCO3- HCO3- |
| C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) |
| D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断:(用化学式表示):
a ;b ; e 。写出由c生成d的化学方程式_____
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a ;b ;c ;并写出由d生成e的化学方程式_____ _______
(10分)原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子2p能级上有两个未成对电子;C的基态原子2p能级上的未成对电子数与A原子的相同;C2-与D+具有相同的电子层结构;E和C位于同一主族,F的原子序数为26。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素A和B的气态氢化物比较, 的沸点特别高。(用化学式填写)
(4)元素A与E所形成晶体属于 晶体
(5)C、D两种元素形成的晶体中阴阳离子的个数比为
(16分)为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的硝酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)准确配制250 mL Na2SO3溶液时,必须用到的实验仪器有:天平、烧杯、玻棒、胶头滴管、药匙和___。
(2)写出Na2SO3固体氧化变质的化学方程式_。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,如何检验是否沉淀完全,其操作是___。
(4)方案I中,若滤液浑浊,将导致测定结果____(选填“偏高”或“偏低”)。
(5)由方案I:Na2SO3固体的纯度可表示为:
(6)方案I、方案Ⅱ :m1 m2(填“>”、“<”或“=”)
(7)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是___。
| A.酸性KMnO4溶液 | B.H2O2溶液 | C.Br2水 | D.FeCl3溶液 |
滴定终点的现象为___________________________
(16分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:① ,② 。
(2)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是 ;锥形瓶里发生反应的离子方程式为
(3)在第②步操作过程中,可加入的有关试剂是 。
| A.酒精 | B.四氯化碳 | C.醋酸 | D.苯 |
(4)含碘离子的溶液也可以采用下图方法得到碘
①加入NaNO2并调节pH<4,反应的离子方程式 __________________。
②流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,
写出反应的化学方程式: ____________________。
(5)要测量含碘离子的溶液中I-的浓度,取25 mL该溶液,先加几滴KSCN溶液,再逐滴滴入0.1 mol·L-1FeCl3溶液, 若消耗FeCl3溶液20.4 mL,则含碘离子的溶液中I-的浓度为 。(保留两位有效数字)
(16分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: ; 。
(2)试剂X是 。由溶液D是 。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;写出反应的化学方程式 ,
(6)工业上常用溶液E经进一步处理可制得净水剂Na2FeO4,流程如下:
①测得溶液E中c(Fe2+) 为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25 % 的H2O2溶液___kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式___________。
(12分)铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。回答下列问题:
(1)Mn2+基态的电子排布式可表示为 。
(2)1mol甲醛(HCHO)中含有的σ键数目为 ;
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方应程式为 。
②[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
| A.配位键 | B.离子键 | C.极性共价键 | D.非极性共价键 |
(5)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、 CuH等。下图是铜的一种氯化物晶体的晶胞结构,则它的化学式是 
 粤公网安备 44130202000953号
粤公网安备 44130202000953号