某校科学研究小组同学开展“二氧化碳的制取与性质”的实验探究。
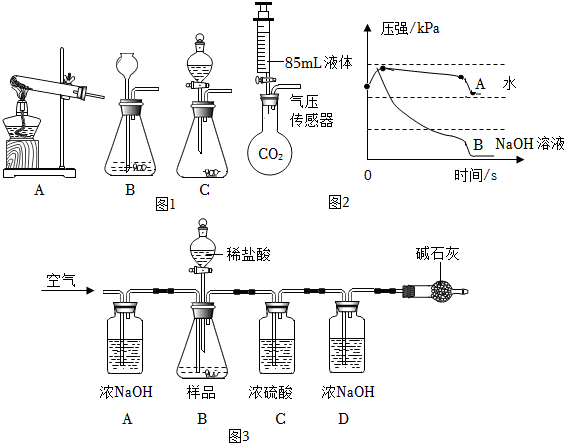
【实验原理】
【发生装置】
(1)结合实验原理,图1中发生装置可用于实验室制取 气体的是: (填字母)
【实验探究】
探究Ⅰ.影响因素探究
在制取 气体时,为了探究影响反应快慢的因素,小组同学进行了四组实验,如表所示
|
实验组别 |
甲 |
乙 |
丙 |
丁 |
|
大理石的质量/g、颗粒大小 |
m块状 |
m块状 |
m粉末状 |
m粉末状 |
|
盐酸的体积/mL、浓度 |
V稀盐酸 |
V浓盐酸 |
V稀盐酸 |
V浓盐酸 |
(2)若探究盐酸的浓度对上述反应的影响,可选择实验甲与 (选填实验组别)进行对照。
探究Ⅱ.性质探究
做 与 溶液发生反应的验证实验时,同学们将 溶液加入到充满 气体且质地较软的塑料瓶中,观察到塑料瓶变扁,由此得到 与 发生反应的结论。但有同学认为上述现象产生的原因还可能是 气体溶于水导致气压减小。
为回答该同学的质疑,小科进行了如下实验:在两个250mL的烧瓶中分别充满 气体,通过注射器同时向两个烧瓶中分别注入同体积的水和 溶液,最后得到烧瓶内压强与时间的关系曲线(如图2所示)。由此,小科得出 气体溶于水会导致塑料瓶变扁,同时 与 也发生了化学反应的结论。
(3)结合图2中A、B曲线变化特点,写出能证明 与 发生了化学反应的证据 。
【拓展提高】
小组同学完成某石灰石样品中 的质量分数测定,其方法是:将样品与一定量的稀盐酸反应,测定反应后生成的 质量,再根据 的质量求出样品中 的质量分数。
小组同学在实验室中组装了相应的实验装置(如图3)。小科利用该实验装置按如下步骤进行实验:
①先通一段时间的空气
②称量D装置的质量为
③打开分液漏斗的活塞,将稀盐酸全部加入锥形瓶,待充分反应后,关闭活塞
④再次通空气一段时间
⑤再次称量D装置的质量为
(4)有同学指出实验步骤③操作明显不合理,你认为该同学的理由是 。
同学们在学习碱的化学性质时,进行了如图所示的实验。实验结束后,将A、B、C三个实验的废液倒入同一个干净烧杯D中,发现烧杯底部有白色沉淀,上层清液呈红色。

【提出问题】烧杯D中上层清液含有哪些溶质(除指示剂外)?
【分析讨论】小组讨论后认为,确定反应后物质成分的思维路径:①考虑反应物用量的不同;②抓住化学反应的本质,即微粒的重组。
某小组同学分析过程笔记如下:
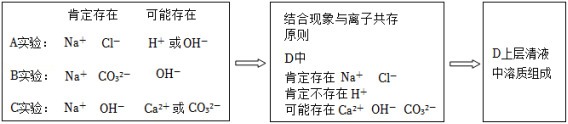
【初步结论】
(1)通过分析确定:烧杯D上层清液中肯定不含 ,肯定含有 、 。判断一定含有 、 。的依据是 ;
【实验探究】
小组按如下方案进行实验探究
|
实验 |
实验内容 |
实验现象 |
实验结论 |
|
Ⅰ |
取少量上层清液于试管中,加入过量碳酸钠溶液,静置 |
无沉淀,溶液呈红色 |
肯定没有 |
|
Ⅱ |
取少量上层清液于试管中,加入过量“?”溶液,静置 |
有白色沉淀,溶液呈红色 |
肯定有 、 |
(2)根据实验Ⅰ可以初步推断:上层清液中溶质(除指示剂外)所有可能的组成 (用化学式表示);
(3)实验Ⅱ中应加入过量的 溶液。
【实验结论】烧杯D中上层清液的溶质有指示剂、氯化钠、氢氧化钠、碳酸钠。
某混合气体X 由 、 、 (水蒸气)、 中的两种或两种以上组成, 气体依次通过如图1装置(假定每步反应均完全),现象分别为:A中溶液变浑浊;B中固体变为红色;C中粉末变为蓝色;D中溶液变浑浊。
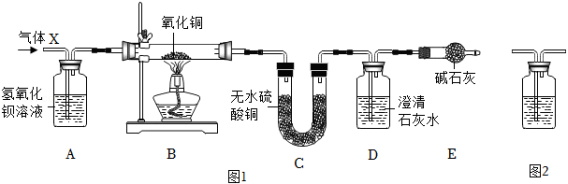
完成下列问题:
(1)该实验能得出 气体一定存在的证据是 ;
(2)只要在图1中加装一个图2装置,就能确定原混合气体 中是否含有 。
①写出图2装置中试剂名称 ;
②该装置连接在图1中哪两个装置之间 (用字母表示)。
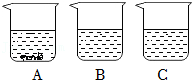
学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50g、25g、5g同种固体物质,充分溶解后,静置,现象如图所示。
回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是 ;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是 。
性能神奇的金属钛( )是航空、军工、电力等领域的重要原材料。常温下钛不与非金属及强酸反应,加热时却可以和常见的非金属单质反应。金红石(主要成分 )是钛矿石之一,目前利用金红石大规模生产钛的过程是:
①在高温条件下在往金红石与碳粉混合物中通入氯气,反应制得四氯化钛( )和一种可燃性气体;
②在氩气的气流中,高温下用过量的镁跟四氯化钛反应制得钛和氯化镁。
完成下列问题:
(1)过程①中发生反应的化学方程式为 ;
(2)过程②中发生的反应,属于基本反应类型中的 。
如图曲线能正确反映下列化学变化中y与x变化关系的是( )

| A. |
锌粒中滴入稀硫酸:y代表氢气的质量 |
| B. |
溶液中通入 气体:y代表沉淀的质量 |
| C. |
氢氧化钠溶液中滴入稀盐酸:y代表混合溶液的pH |
| D. |
和 的混合溶液中加入 溶液:y代表沉淀的质量 |
推理是根据已有的事实与结论推出新的判断的思维方法。下列根据已有事实或结论进行的推理正确的是( )
|
选项 |
事实或结论 |
推理或判断 |
|
A |
酸性溶液pH小于 7 |
pH小于7的溶液一定是酸性溶液 |
|
B |
碱能使无色酚酞溶液变红 |
能使无色酚酞溶液变红的一定是碱 |
|
C |
酸与碱反应生成盐和水 |
生成盐和水的反应一定是酸与碱的反应 |
|
D |
氧化物中都有氧元素 |
含有氧元素的化合物都是氧化物 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
“宏观—微观—符号—量”是科学特有的表征物质及其变化的方法。2022年4月16日,神舟十三号载人飞船圆满完成飞行任务。火箭助推器使用偏二甲肼和四氧化二氮作为推进剂,燃烧时发生反应的微观示意图如图,下列说法不正确的是( )
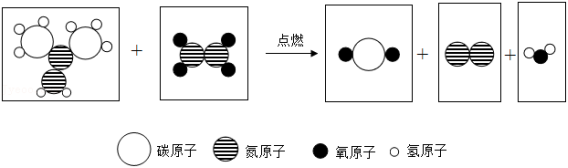
| A. |
从量的角度看:反应前后原子总数减少 |
| B. |
从微观构成看:氮气是由氮分子构成的 |
| C. |
从符号表征看:四氧化二氮的化学式是 |
| D. |
从宏观物质看:燃烧产物中含有单质与化合物两类物质 |
科学以实验为基础,规范操作是科学实验取得成功的关键。下列实验操作规范的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
学习小组用已知浓度的氢氧化钠溶液测定某硫酸溶液的浓度。取该硫酸溶液20g,滴加10%的氢氧化钠溶液,恰好完全反应时,共消耗氢氧化钠溶液40g。计算:
(1)消耗的 溶液中溶质的质量为 g;
(2)该硫酸溶液的溶质质量分数。(温馨提示: )
有一包白色粉末,可能由 、 、 、 、 中的一种或几种组成,为确定其成分,某化学兴趣小组进行如下实验探究,请你参与探究并回答相关问题。
【提出问题】该白色粉末的成分是什么?
【查阅资料】
(1)部分物质在水中的溶解性表(室温):
|
物质 |
|
|
|
|
|
溶解性 |
溶 |
不溶 |
微溶 |
不溶 |
(2) 不稳定,在溶液中分解生成难溶于水的物质。
【实验探究】
|
实验步骤 |
实验现象及结果 |
实验结论 |
|
①取该白色粉末样品于烧杯,加足量水溶解。 |
样品全部溶解,得到无色溶液A |
白色粉末中不含 |
|
②取少量无色溶液A于试管,加入过量 溶液,充分反应后过滤。 |
得到无色溶液B和白色沉淀C |
白色粉末中含有 |
|
③向白色沉淀C中加入过量稀盐酸。 |
沉淀部分溶解,并有气泡冒出 |
|
|
④在无色溶液B中滴加几滴 溶液。 |
产生白色沉淀 |
白色粉末中含有 |
【交流与解释】
(1)白色沉淀C中加入过量的稀盐酸,产生气泡的反应方程式为 。
(2)在老师的指导下,通过讨论,同学们认识到由上述实验探究尚不能得出白色粉末中含有 ,理由是 。
为了进一步确定白色粉末中是否含有 ,继续进行如下探究。
【继续探究】
|
实验步骤 |
实验现象 |
实验结论 |
|
⑤另取少量无色溶液A于试管中,加入过量的 溶液,振荡,静置。 |
产生白色沉淀 |
白色粉末中含有 |
|
⑥取实验⑤所得上层清液于试管,加入 溶液。 |
产生白色沉淀 |
通过上述实验探究,确定了该白色粉末的成分。
【拓展与反思】在混合溶液中,检验某种离子时,需排除离子间的相互干扰。
化学是一门以实验为基础的科学。请结合图示回答问题:

(1)仪器①的名称为 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 。用B、E装置制取并收集氧气,实验操作步骤有:①点燃酒精灯,待气泡连续均匀放出时收集气体;②熄灭酒精灯;③装入药品,放置棉花并固定仪器;④连接好装置,检验装置的气密性;⑤从水槽中撤出导管。正确的操作顺序是 (填标号)。
a.③④①②⑤
b.④③①⑤②
c.④③①②⑤
d.③④①⑤②
(3)进行铁丝在氧气中燃烧的实验,集气瓶底部加入水或细沙的目的是 。
(4)实验室用锌粒和稀硫酸制取氢气,应选择的发生装置是 (填标号,下同),可选择的收集装置是 (填一种即可)。
(5)现有一新制的碳酸钙产品,某同学设计如图所示的实验,通过测定反应生成的 的质量来确定该产品中 的含量(图中夹持仪器已略去,杂质不与盐酸反应,碱石灰是 和 的固体混合物)。

①关闭止水夹,打开分液漏斗活塞,缓慢滴加盐酸至不再有气泡产生,关闭分液漏斗活塞;打开止水夹,缓缓通入空气。通入空气的作用是 。
②装置D的作用是 。
③实验时,称取的碳酸钙产品的质量为 ,反应后得到 的质量为 ,则该产品中 的质量分数为 (用含 和 的代数式表示)。
氨既是一种重要的化工产品,又是一种重要的化工原料。如图为合成氨以及以氨为原料制硝酸的流程示意图。
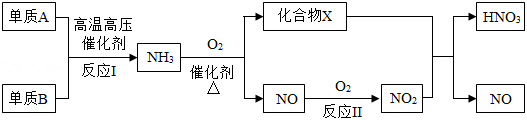
(1)化合物X是一种常见溶剂,其化学式是 。
(2)反应Ⅱ属于 反应(填基本反应类型)。
(3)反应Ⅰ的化学方程式是 。
金属及金属材料广泛应用于生产、生活及科学实验,其应用推动了社会的发展。
(1)下列实验中,铜片上的白磷燃烧,说明铜具有 性;黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度 (填“大”或“小”)。

(2)铁在潮湿的空气中容易生锈,写出一种防止铁制品生锈的具体方法 。
(3)春秋战国时期,我国就开始生产和使用铁器。工业上用赤铁矿(主要成分 )和一氧化碳反应炼铁的化学方程式为 。
(4)某同学对含 、 、 的混合溶液进行探究,流程如下(M表示一种金属元素):
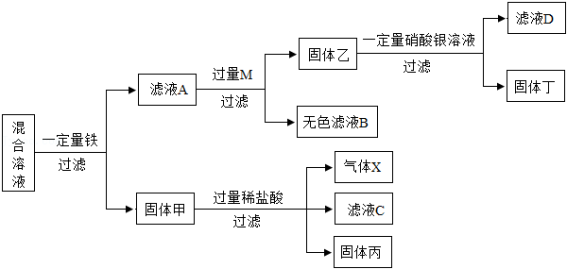
根据实验探究流程,回答下列问题:
①气体X的化学式为 ;
②金属 、 、 、 的活动性由强到弱的顺序是 。
③滤液D中所含溶质的成分可能有 种情况。
2022年3月22日是第三十届“世界水日”,其主题为“珍惜地下水,珍视隐藏的资源”。
(1)地下水是 (填“混合物”或“纯净物”)。
(2)实验室制取蒸馏水时,在烧瓶中加入几粒沸石或碎瓷片的目的是 。实验结束,可加入 比较水蒸馏前后的硬度变化。
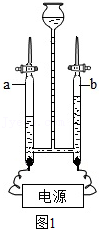
(3)宇航员一部分生活用氧可通过电解水制得。如图1是电解水的实验示意图,玻璃管 (填“a”或“b”)中的气体能使带火星的木条复燃。该实验说明水是由 组成的。
(4)机场、车站等公共场所设有许多直饮水机,能将自来水进一步净化处理得到可直接饮用水,其处理水的过程如图2所示。
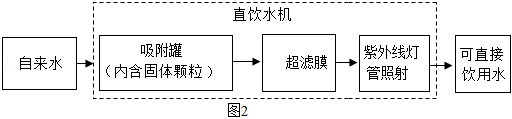
吸附罐中固体颗粒的主要作用是吸附杂质,固体颗粒可选用 ,紫外线灯管照射的作用是 。
(5)图3是我国“国家节水标志”,用一句话谈谈你对该标志的理解或得到的启示 。
