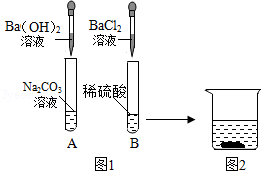
为了探究物质的化学性质,某兴趣小组做了如图1所示实验。实验结束后,小组同学将A、B两支试管中的上层清液倒进一洁净的烧杯中,观察到一会儿后才有气泡产生,然后有白色沉淀生成(如图2)。
请回答下列问题:
(1)Na2CO3溶液呈 性。
(2)B试管中出现的现象是 。
(3)A试管中的物质充分反应后,所得溶液的溶质有 。
(4)写出烧杯中有气泡产生的反应的化学方程式 。
(5)小组同学将烧杯内的物质进行过滤。为了确定滤液中溶质的成分,小组同学进行了如下探究。
【作出猜想】猜想Ⅰ:NaCl
猜想Ⅱ:NaCl、NaOH
猜想Ⅲ:NaCl、BaCl2
【评价交流】你认为以上猜想 不合理,理由是 。
则你的猜想为 。
【实验验证】小组同学取少量滤液于试管中,只加入一种溶液,就确定了滤液的溶质成分,加入的溶液是 。
【总结归纳】可溶性物质反应后,所得溶液中溶质的组成最简单的情况是:反应物 。
增氧剂可用于给鱼池增氧,某化学兴趣小组对某种增氧剂的增氧原理进行实验探究。
【查阅资料】该增氧剂的主要成分是过碳酸钠,过碳酸钠是一种白色晶体,化学式可以表示为2Na 2CO 3•3H 2O 2。过氧化氢溶液常温较稳定,能缓慢分解,受热容易分解。
【提出问题】增氧剂真的能增氧吗?
【初次探究】取少量增氧剂于试管中,加入足量蒸馏水,观察到固体完全溶解,形成无色溶液,无气泡产生;加热,产生大量气泡。
【作出猜想】该兴趣小组结合资料和实验现象推测增氧剂溶于水后生成Na 2CO 3和H 2O 2。
【再次探究】该兴趣小组进行如表实验:
| 实验操作 |
实验现象 |
实验结论 |
|
| (1) |
另取少量增氧剂于试管中,加入足量蒸馏水,待其完全溶解,再加入 ,将带火星的木条伸入试管内 |
|
溶液中含有H 2O 2。该操作中H 2O 2参与反应的化学方程式为 |
| (2) |
待步骤(1)完全反应后,将所得物质过滤,取少量滤液于另一支试管中,加入 |
产生白色沉淀 |
溶液中含有Na 2CO 3 |
【得出结论】该增氧剂的增氧原理为 。
【评价反思】该增氧剂的保存方法为 。
市售的"自热米饭"带有一个发热包,遇水后可迅速升温至150℃,保温时间达3小时,能将生米做成熟饭。梧州市某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
【查阅资料】
(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液。
【成分探究】取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)小吴用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有 。用磁铁将该物质全部吸出后,剩余粉末为样品A。
(2)小周将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变 色,证明原粉末中含生石灰;再向滤液中加入 ,看到白色沉淀生成,证明原粉末中含有氯化钠。
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五: 。
【实验验证】小施用样品A进行实验,流程如下。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。
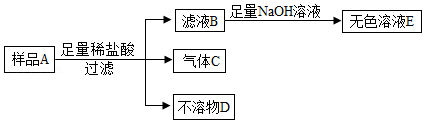
【实验结论】
不溶物D是 。
大家结合实验现象讨论后,认为猜想 正确,理由是 。
【原理探究】
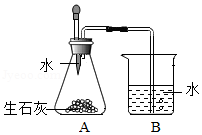
小吴利用如图装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为 (填名称)。但温度很快下降,说明该反应很快结束,不能长时间保温。
【猜想】大家大胆猜测应该还有其他放热反应存在。
【实验验证】
同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
【拓展活动】
在上述铁的锈蚀实验中未观察到红色的铁锈产生。老师告诉同学们,铁锈蚀时首先生成一种碱。请写出该反应的化学方程式 。
根据如图回答问题:

(1)实验室用高锰酸钾制取氧气的化学方程式为 ,实验室用过氧化氢溶液制取氧气,选用的发生装置是 (填字母序号),用C装置收集氧气时,检验O 2的方法是 ;
(2)实验室可以用装置D制取并收集二氧化碳气体,收集时,检验CO 2已经收集满的方法是 .检验CO 2的方法是 (用化学方程式表示);
(3)检查装置E的气密性:看到 ,说明气密性良好;
(4)实验F中观察到的实验现象是 ,反应的化学方程式为 .
实验室存放盐溶液的柜子里,有一瓶无色溶液的标签因受到腐蚀而破损,如图所示。某兴趣小组同学对其成分进行探究。
【提出问题】这瓶是什么溶液呢?
【猜想与假设】经了解得知,这瓶无色溶液可能是碳酸钾、硫酸钾、氯化钾、硝酸钾中的某一种溶液。
【推理分析】小组同学为了确定该溶液的成分,他们进行了以下分析:
(1)甲同学根据物质的组成元素认为一定不可能是 溶液。
(2)乙同学认为也不可能是硝酸钾溶液,他的依据是 。
【设计实验】为了确定该溶液究竟是剩余两种溶液中的哪一种,丙同学设计了如下实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,逐滴加入氯化钡溶液 |
产生白色沉淀 |
该溶液一定是碳酸钾溶液 |
【实验反思】
(1)丁同学认为丙的结论不合理,理由是 。
(2)在丙同学实验的基础上,丁同学继续进行实验,实验方案如下:
| 实验操作 |
实验现象 |
实验结论 |
| 取丙同学实验所得的白色沉淀于试管中,滴加适量的 ,振荡 |
, 沉淀溶解 |
该溶液是碳酸钾溶液。 反应的化学方程式是 |
(3)为防止标签受到腐蚀,倾倒液体时应注意: 。
在酸和碱的中和反应中,氢氧化钠与稀盐酸反应现象不明显。为证明两者发生化学反应,在老师指导下开展了系列探究活动,选取以下三组实验方案进行分析讨论,请你参与其中。
[学生实验]
方案 |
实验方法 |
实验操作 |
实验现象 |
实验分析 |
一 |
测定滴加过程中温度变化 |
室温时,将温度传感器放入氢氧化钠溶液中,然后逐滴加入稀盐酸至过量,得到温度变化图像。 |
|
氢氧化钠和稀盐酸发生的反应是 _____反应(填写“吸热”或“放热”)。 图中_____点表示氢氧化钠与稀盐酸恰好完全反应(填写字母)。 |
二 |
用酚酞溶液作指示剂检测 |
反应前向氢氧化钠溶液滴加酚酞溶液。 |
溶液显_____色 |
氢氧化钠与稀盐酸混合发生反应,其化学方程式 _____ |
然后逐步加入稀 盐酸至过量。 |
溶液颜色逐渐变浅至无色 |
|||
三 |
用pH试纸检测酸碱混合后溶液的酸碱性 |
用洁净、干燥的玻璃棒蘸取少量混合液滴在干燥的 试纸上,观察颜色变化并与标准比色卡比较。 |
①若试纸变蓝色 |
_____ ,溶液呈碱性(填“>”“=”或“<”)。 |
②若试纸不变色 |
,溶液呈中性。 |
|||
③若试纸变红色 |
,溶液呈 _____性。 |
|||
能证明氢氧化钠和稀盐酸混合恰好完全反应的实验现象是_____( 填写序号)。 |
||||
图1是实验室制取常见气体的装置,图2是探究铁生锈条件的实验装置,回答下列问题。
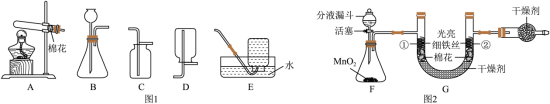
(1)用大理石和稀盐酸制取 的化学方程式为__________,发生装置是_____(填字母序号)。
(2)加热高锰酸钾制取 的化学方程式为__________,收集装置是_____(填字母序号),检验 的方法是_____。
(3)装置F中分液漏斗内的试剂是_____,打开活塞,缓慢滴加试剂,持续反应5分钟后,装置G中的现象是_____,达到实验目的。
(4)火星的大气中含有大量 ,科学家认为人类未来建设火星基地时,能利用火星大气中的 制取 ,理论依据是_____。
小明按如图所示进行趣味实验,将U形管开口端放入烧杯内,观察到溶液进入U形管并流入另一端。
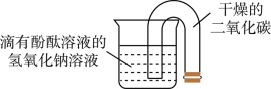
(1)烧杯内的溶液呈_____色。
(2)二氧化碳与氢氧化钠溶液反应的化学方程式为_____。
(3)U型管开口端放入烧杯后,管内气体压强_____(选填“增大”“不变”或“减小”),溶液在管内上升并流入另一端。
电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图所示。
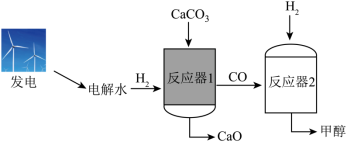
(1)传统方法: 在 以上完全分解生成 和__________(填化学式)。
(2)新方法:
i.电解水属于_____反应(填基本反应类型),反应前后氢元素的化合价_____(填“升高”“降低”或“不变”)。
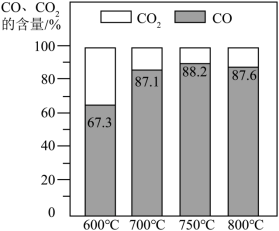
ii.反应器1:一定的 环境及较低温度下 可与 反应生成 和 。 与 的分子个数比为_______。
还可以直接分解。反应器1中 、 的含量随反应温度的变化如下图所示。________ 时,抑制 生成的效果最好。
iii.反应器2:一定条件下, 与 发生化合反应生成甲醇( ),化学方程式为_________ 。
(3)与传统方法相比,新方法的优点有__________________________(写两条)。
定律是对自然现象或关系的描述,通常可用数学方式加以表达。在学习“质量守恒定律”时,小丽查阅到以下材料:
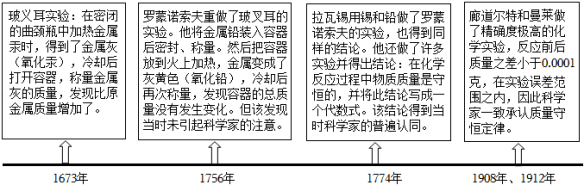
(1)玻义耳实验中,金属灰增加的质量是 ;
(2)质量守恒定律的发现过程,带给我们的启示有 (填字母);
A.要善于总结前人的成果和经验
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
受上述研究启发,小丽对相关实验进行了深入探究。
(3)在白磷燃烧前后质量测定实验中(如图),气球的作用有 ;

(4)小丽认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不符合质量守恒定律。请你设计一个能说服小丽的简明实验思路 。
实验是科学探究的重要手段。如图是实验室制取气体的常用装置,请回答有关问题:

(1)仪器①的名称 。实验室利用高锰酸钾制取氧气的装置中,试管口略向下倾斜的原因是 。
(2)实验室里,在常温下用硫化亚铁固体和稀硫酸反应来制取硫化氢气体。通常情况下,硫化氢是一种无色、有臭鸡蛋气味的有毒气体,能溶于水,密度比空气的大。实验室制取硫化氢气体应选用的发生装置是 (填序号),收集装置是 (填序号)。
如图是实验室常用气体制备装置,据图回答问题:
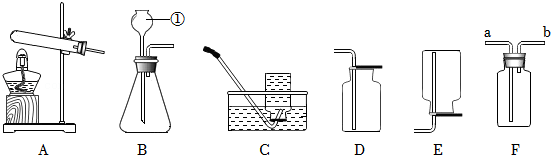
(1)图中仪器①的名称是 ;
(2)实验室用过氧化氢和二氧化锰制取氧气,反应的化学方程式是 ;
(3)实验室制取二氧化碳,可选用的收集装置是 ,若将产生的二氧化碳通入紫色石蕊溶液中,溶液变红色,其原因是 (写出化学方程式);
(4)实验室常用无水醋酸钠固体和碱石灰固体在加热条件下制取甲烷,应选用的发生装置是 ;若用 F 装置收集甲烷,则气体从导管口 进(填“a”或 b )。
有一瓶因久置而失去标签的无色溶液、为鉴定该溶液的成分,小亮进行了下面的实验:
(1)取一支洁净试管,倒入3~5mL待测溶液,滴加2~3滴石蕊试液,石蕊试液变红色,该溶液呈 (填“酸性”“碱性”);
(2)另取一支洁净试管,倒入3~5mL待测溶液,加入几粒锌粒后有气泡冒出,该溶液一定是 溶液;
(3)要确定该溶液是稀硫酸还是稀盐酸,小亮还需要补充的实验是:
实验步骤 |
现象 |
实验结论 |
|
|
|
根据下列装置,结合所学化学知识,回答下列问题。
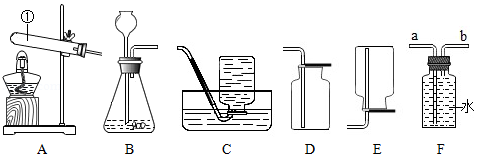
(1)仪器①的名称是 。
(2)若用氯酸钾和二氧化锰混合加热制备并收集干燥的氧气,你应选择 装置组合(填序号),该反应的化学方程式为 ;其中二氧化锰是该反应的 。
(3)某同学用石灰石与稀盐酸反应制取气体,他应该选择的发生装置为 (填序号),他想知道该气体是否是二氧化碳,正确的检验方法是 。
A.将该气体通入澄清石灰水观察是否变浑浊
B.将燃着的小木条放在导管口看是否熄灭
(4)某同学用F装置收集氢气。他应该将氢气的发生装置与F装置的 端相连(填"a"或"b"),请你分析能用F装置收集氢气的原因 。
初中化学课本中的部分实验如图。请你回答下列问题。

(1)图1是检查装置气密性的实验。将导管放入水中的目的是 ,证明装置不漏气的现象是 。
(2)图2是验证质量守恒定律的实验装置。在锥形瓶瓶塞上的玻璃管外端套一个瘪气球,瘪气球的作用是 。
(3)图3是过滤液体的实验。倒入液体时漏斗内液面要低于滤纸边缘,主要是为了防止 。
(4)图4是验证二氧化碳与水反应的实验。其中的花朵是用石蕊溶液染成的紫色干燥纸花。把石蕊小干花一半喷水后放入盛满二氧化碳的集气瓶中,观察到的现象是 ,石蕊小干花喷一半水的目的是 。