1674年,英国化学家约翰•梅猷为测定空气中的氧气含量开展如下实验(装置如图甲)。
I.将一根长度等于玻璃钟罩最宽部分直径的铁棒橫放在钟罩里,把装有稀硝酸的陶罐通过铁钩挂在铁棒上,用绳索将小铁块悬挂在陶罐的正上方(铁块的升降通过在钟罩外拉动或放松绳索来实现)。

Ⅱ.调整水槽中初始水位如图乙,再使铁块浸入稀硝酸中,观察到铁块表面迅速产生大量气泡,钟罩内水面下降。[稀硝酸有强氧化性,能与铁发生如下反应:4HNO3+Fe═Fe(NO3)3+NO↑+2H2O]
Ⅲ.当水位降至接近钟罩口时(如图丙),立即取出铁块,以防气体外逸。
IV.等待一段时间后,水面稳定在如图丁的位置。(一氧化氮会与氧气等物质发生如下反应:4NO+3O2+2?=4HNO3)
分析与评价:
(1)步骤Ⅳ中的“?”处应填 。
(2)从图丙到图丁过程中,钟罩内水位上升的原因是 。(忽略温度变化的影响)
(3)小科重复了上述实验,虽实验时装置气密性良好,且钟罩内液面上方气体体积均能精确测量(即测定气体体积的误差忽略不计),但经过多次实验测定,发现每次测得空气的含氧量都小于 ,原因是 。
孔雀石主要成分为Cu2(OH)2CO3 (难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4•5H2O)的部分工艺流程如图。
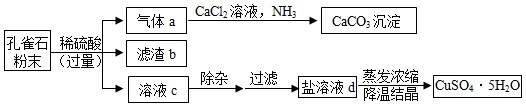
请回答:
(1)滤渣b的化学式为 。
(2)溶液c中的溶质有(写化学式):H2SO4、 、 。
(3)盐溶液d的颜色为 ;实验室蒸发溶液时用到的玻璃仪器有 (写1种)
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的名称为 ;孔雀石与稀硫酸反应生成气体a的化学方程式为 。
(1)如图是利用海盐提取粗盐的过程:

如图中①是 池(填“蒸发”或“冷却”)。
(2)粗盐中含有少量CaCl2、MgCl2、Na2SO4和泥沙,某同学将该粗盐样品进行提纯。
①将样品加适量水溶解,然后进行 ,除去泥沙等难溶性杂质,得到澄清溶液;
②向所得的澄清溶液中依次加入稍过量的BaCl2溶液、NaOH溶液和 溶液,除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液;
③蒸发溶液,得到较多氯化钠固体时停止加热,他注意到不能立即把 直接放在实验台上,以免烫坏实验台。
(3)另一同学用所得的氯化钠和蒸馏水配制溶质质量分数为6%的氯化钠溶液。配制步骤: ①称量和量取 ②溶解 ③计算 ④装入试剂瓶贴好标签。配制上述溶液的正确顺序是 (填序号)。
室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
| 温度(℃) |
0 |
20 |
25 |
40 |
50 |
60 |
80 |
| 溶解度(g) |
69.2 |
74.5 |
76.4 |
81.8 |
85.5 |
89.4 |
98.0 |
步骤Ⅱ:配制少量CuCl 2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl 2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl 2的质量是 g。
②将称取的CuCl 2固体和20mL水倒入烧杯中, (填操作名称),直至固体完全溶解。
(2)母液中Cu 2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是 。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO 3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是 g(只列计算式,已知CuCl 2的相对分子质量为135)。
化学促进科技发展,推动社会进步。
(1)中国提出在2030年前实现碳达峰,2060年前实现碳中和,彰显了大国责任与担当。
①如图是碳元素在元素周期表中的部分信息。碳元素的质子数是 ,属于 (填“金属”或“非金属”)元素。
②减少 排放,可以减缓 效应。
③自然界中消耗 的主要途径是 。
④为实现碳达峰、碳中和的目标,请写出你的做法 (一条即可)。
(2)2022年6月5日神舟十四号载人飞船成功发射,沈阳航天新光集团有限公司承制生产的连接分离机构再次为发射任务保驾护航。
①载人飞船的制造使用了大量合金,合金的硬度一般比各成分金属 。
②航天员穿着的航天服使用了多种合成纤维,合成纤维属于 (填字母序号)。
| A. |
无机材料 |
| B. |
合成材料 |
| C. |
复合材料 |

开春以来,为提高水稻产量,某农场积极做好科学施肥、精准防治病虫害等工作。
(1)水稻不同生长期需要不同的肥料。如在水稻抽穗、开花时期,为促进穗数增多、籽粒饱满,需要多施磷肥。下列属于磷肥的是 。
| A. |
碳酸钾( ) |
| B. |
尿素[ ] |
| C. |
磷酸二氢钙[ ] |
(2)氮肥能促进水稻幼苗生长。一百亩水稻需要施碳酸氢铵3950千克,用氨气、水和二氧化碳反应来制取,化学方程式为 ,需要氨气多少千克?
(3)井冈霉素是防治水稻纹枯病的常用药。要为一百亩水稻喷洒一次这种农药,需要配制溶质质量分数为0.01%的药液7500千克,应购买5%的井冈霉素药液 千克。
2022年我国将有6名航天员生活在空间站。氧气、水、食物等是维持航天员驻留空间站的必要物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用:
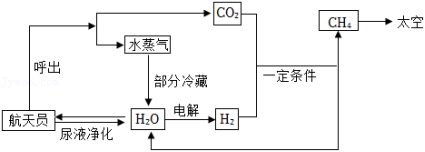
(1)由图可知,目前空间站通过物质循环获得水的途径共有 条,其中尿液净化时必须除去尿液中的 等代谢废物。
(2)为实现氧的循环,目前空间站内利用氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,化学方程式为 。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约1.1千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
举重前运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果,某种“镁粉”中只含有 、 、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、 、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡。请结合实验现象和数据回答问题。
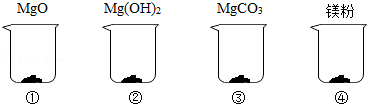
|
物质 |
|
|
|
“镁粉” |
|
消耗稀盐酸的质量/克 |
121.8 |
|
58.0 |
61.9 |
(1)烧杯③中产生的气体是 。
(2)“镁粉”中不只含有 一种物质,理由是 。
(3)表格中 的值为多少?(请写出计算过程)
(4)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和 各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升。由此可知该种“镁粉”的成分是 。
化学是一门以实验为基础的自然科学
(一)实验帮助我们研究物质的组成
如图是测定空气中氧气体积分数的实验装置,请回答下列问题:

(1)红磷在空气中燃烧的现象是 ,发生反应的化学方程式为: 。
(2)实验结论:氧气约占空气总体积的 。
(二)实验帮助我们研究物质的性质
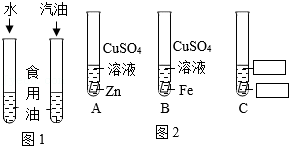
(3)图1实验中,食用油溶解于 中,该实验表明影响物质溶解性的因素是 。
(4)图2试管B中发生反应的化学方程式为: 。
(5)为了探究 、 、 的金属活动性顺序,图2试管C中需要补全的一组试剂是 。
(三)实验帮助我们研究物质的制法
实验室模拟炼铁原理的装置如图所示,请回答下列问题:
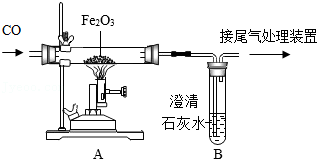
(6)写出A装置玻璃管中发生反应的化学方程式: ,该反应前后碳元素化合价发生的变化是 。
(7)B装置中的现象是 。
(8)实验中需要进行尾气处理的原因是 。
如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO 4)
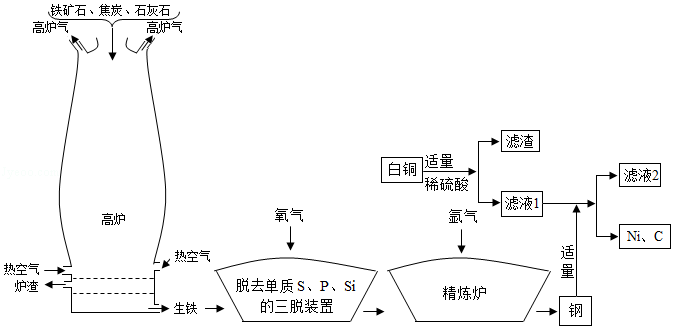
(1)用高炉冶铁的主要反应原理是 (用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是 。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中 (填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性 镍(选填">"、"="或"<"),判断依据是 (用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是 ,其硬度比纯铜 (填"大"或"小")。
某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:

(1)能产生气泡的是 (填序号)。
(2)溶液变为蓝色的是 (填序号),写出其中发生的化学方程式 。
(3)能证明C中发生了反应的现象是 。
(4)实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。
【提出问题】铜与硫酸真的不能反应吗?
【查阅资料】
①铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
②SO2能使品红溶液褪色;
③SO2能与碱溶液反应;
④SO2能溶于水,但不溶于饱和NaHSO3溶液
【进行实验】
同学们在老师的帮助下用如图所示装置进行实验:

请回答下列问题:
(1)实验开始时,打开开关K,发现D中品红溶液褪色,装置D中试管口放置的棉花上浸有浓氢氧化钠溶液,其作用是 。
(2)装置B的作用是收集贮存多余的气体,当D中有明显现象后,关闭K,移去酒精灯,但由于余热的作用,A有仍有气体产生,此时B中现象是:长颈漏斗内液面 (填“上升”或“下降”),则B中盛放的液体为 (填序号)。
A.水
B.氢氧化钠溶液
C.饱和石灰水
D.饱和NaHSO3溶液
【知识拓展】化学反应的进行与物质的溶质质量分数,反应条件都有一定的关系。
掌握化学知识有利于我们更好地生活。
(1)在炎热的夏天,应该把自行车停放在阴凉处,防止因暴晒而爆胎。请用微观粒子观点解释爆胎的原因: 。
(2)家庭使用燃气时要特别注意安全,当发现燃气泄漏时,一定要防止电火花的产生,否则可能发生 现象。
(3)沙漠地区的铁制品锈蚀较慢的原因是 。
(4)主要成分为氧化钙的食品干燥剂与水接触时会对人体造成伤害,因为氧化钙与水反应生成具有腐蚀性的碱溶液,同时还能 。
某化学小组选用如图部分装置制取纯净、干燥的CO2。

(1)写出A中所发生反应的化学方程式 。
(2)若将a、b连接,B中溶液不变浑浊,这是因为CO2中混有哪种杂质? 。
(3)为达到实验目的,所选用装置的导管接口从左到右的正确连接顺序为: a接 、 接 、 接j。
(4)用F收集CO2,j为进气口。请将F中的玻璃导管补画完整。
甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全国最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想]甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按如图1进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是 。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用如图2进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
(1)实验前要通一会儿氮气,目的是 。
(2)A装置中发生反应的化学方程式为 。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g,E装置增重8.36g。(产物被完全吸收)
[分析与讨论]数据分析:4.02g 甜叶菊苷中氧元素的质量为 g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是 。 (填“偏大”、“偏小”或“无影响”)。