A—F表示初中化学常见的物质,A和B、B和C都能发生反应,且都只能生成两种产物,它们之间的转化关系如图所示。若B是目前世界上年产量最高的金属,D是一种红的单质,F是一种气体。
(1)写出D物质的一种用途 。
(2)反应①的基本反应类型为 。
(3)反应②的化学方程式为 。
某小组同学在实验室中欲从含有硫酸亚铁、硫酸铜的废液中回收金属铜,过程如下:
(1)操作I、操作Ⅱ的名称是 ,该操作中玻璃棒的作用是 。
(2)固体X中含有 。
(3)溶液B中溶质的化学式为 。
某学生为探究铁、铜、银三种金属的活动性顺序,设计了四种方案:①将Fe、Ag分别加入到CuSO4溶液中;②将Fe、Ag分别加入到FeSO4溶液中;③将Fe分别加入到CuSO4、AgNO3溶液中;④将Cu 分别加入到FeSO4、AgNO3溶液中。其中可行的方案有
| A.①或④ | B.①或② | C.②或③ | D.③或④ |
(15分)人类的生活和生产都离不开金属材料。
(1)铁是目前年产量最高的金属。
①高炉炼铁时需要的主要原料有铁矿石、焦炭、_______等。
②炼铁的反应原理主要是利用CO把铁从铁矿石中______出来(填“置换”或“还原”),表示该原理的化学方程式是__ _ _。
③下列说法正确的是__________________。(填字母序号)
| A.铁生锈就是铁与空气中的氧气发生的化学反应 |
| B.回收废旧金属有利于节约金属资源 |
| C.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁 |
| D.在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液 |
(2)请你参与探究几种常见金属饰品所含金属的相关活动,并回答下列问题。
【提出问题】Ⅰ.怎样鉴别真假黄金?Ⅱ.怎样确定钯的金属活动性?
【查阅资料】假黄金通常是黄铜(Cu﹣Zn合金);
钯(Pd)呈银白色,有金属光泽,可用作饰品
【实验药品】钯(Pd)、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
①鉴别黄金样品的真假:取黄金样品于试管中,滴加稀盐酸后,观察样品表面有气泡产生,说明此样品为 (填“真”或“假”)黄金,其中发生的反应方程式为________。
②探究钯的金属活动性:依据生活经验,同学们猜测钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
无明显现象 |
钯的活动性比银 。(填“强”或“弱”) |
| 把铂浸入氯化钯溶液中 |
_________ |
钯的活动性比铂强。 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为____ 。
(3)现用一定量的AgNO3和Cu(NO3)2混合溶液,进行了如图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO)3
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是__ _____(填标号),其理由是____ ___。
【实验探究】根据下表中的实验步骤及现象,完成表中的实验结论
| 实验步骤 |
现象 |
实验结论 |
| 取少量固体B,滴加稀盐酸 |
有气泡产生 |
溶液A中的溶质成分符合猜想 _, 固体B中的金属成分有 _种。 |
化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是 ;
(2)写出步骤②中产生气体的化学方程式 ;
(3)写出步骤③中的反应现象 ;
(4)滤液C中一定含有的溶质是 可能含有的溶质是 ;
铁是生产、生活中应用广泛的金属材料。
(1)在酱油中加入铁强化剂,可预防 (填“佝偻病”、“贫血”或“骨质疏松”)。
(2)某种含铁粉的麦片,食用后在胃酸(盐酸)作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。
(3)对铁质零件进行“发蓝”处理后,其表面会形成致密氧化膜,从而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是________________。
②为检验“发蓝”处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,由此可知“发蓝”处理效果不好,因为________________(用化学方程式表示)。
(4)某同学对X、银、铜、铁四种金属混合物的成分进行探究,流程如下: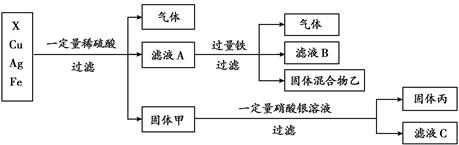
①四种金属的活动性由强到弱的顺序是 。
②固体丙的组成可能是 。
金属锰(Mn)通常显+2价,锰在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是
| A.Mn+2HCl=MnCl2+H2↑ |
| B.Mg+MnSO4=MgSO4+Mn |
| C.Mn+Cu(NO3)2=Mn(N03)2+Cu |
| D.Fe+MnSO4=FeSO4+Mn |
同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序。实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
(1)小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中; ②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中; ④把铜丝插入装有AgNO3溶液的试管中。
观察到①中的实验现象是 ,④中的化学方程式是 。你认为小华所做的实验 (填序号)是多余的。
(2)后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的。他选用的三种药品是 (写出一种药品组合即可)。
小贝还想探究Zn、Fe、Cu的活动性顺序,设计了如图的两个实验:小贝以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 。
把铝箔放入CuCl2溶液中,铝箔表面覆盖了红色物质,一会儿又有大量气泡冒出。同学们对“放出气体”这一异常现象进行猜想、实验。其中没有价值的是
| A.小宇同学推测气体是氢气并检验 | B.小琪同学猜想CuCl2溶液可能含有盐酸 |
| C.小寒同学认为气体是氨气并检验 | D.小梁同学认为试剂变质,更换后再实验 |
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
【结论与解释】
(1)小聪得到的结论是猜想 正确。
(2)实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,
请你写出反应的化学方程式 。
现有等质量的X、Y两种金属,分别放入浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X、Y在生成物中化合价均为+2价)。则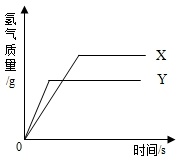
下列说法中不正确的是
| A.生成氢气的质量:X﹥Y | B.金属活动性:Y﹥X |
| C.消耗硫酸的质量:X﹥Y | D.相对原子质量:X﹥Y |
工业上生产电路板及处理废液的工艺流程如下:
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生的化学反应方程式为______________________。
(3)步骤③加入稀盐酸,充分搅拌,当观察到________________________时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为___________。
(1)目前世界上一半以上的铜用于电力和电信工业,是因为铜具有 (填字母)
| A.导热性 | B.延展性 | C.导电性 | D.金属光泽 |
(2)我国第四套人民币的硬币从1999年开始发行,一元为钢芯镀镍(Ni),五角币为钢芯镀铜合金,一角币为铝合金或不锈钢。在选择铸造硬币的材料时需要考虑的因素是有 (填一条即可)。
①镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍的化合物,并放出氢气。其反应没有铁与酸反应剧烈。镍与盐酸反应的化学方程式为 .
②用镍片、硫酸亚铁溶液和 溶液做实验也能判断Ni 、Fe、Cu的金属活动性顺序。三种金属的活动性顺序为 。
(3)若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 。
(4)活动课上小明将一枚五角币放在酒精灯火焰上加热片刻,发现表面变黑。
【假设与预测】假设Ⅰ.五角币加热变黑,是因为酒精灯内焰的黑烟附着在五角币的镀铜上;
假设Ⅱ.五角币加热变黑,是因为五角币上的镀铜与 ______发生了化学反应。
【实验与事实】
实验一:用洁净的干布擦一擦五角币上的黑色物质,黑色物质不易被擦去;再另取一枚五角币放在石棉网上,用酒精灯加热片刻,五角币也变黑。
实验二:取一块铜片放入小试管中并塞上橡皮塞,然后用酒精灯加热直至试管中铜片变黑;再将铜片反转到另一面,加热片刻,铜片不再变黑。
【解释与结论】上述实验一和实验二证实,假设 __ ___ 不成立。
【表达与交流】铜片在空气中加热,发生的化学反应方程式为___ ___ 。