小明测得石灰石与一定量的稀盐酸反应后的溶液PH为2,也适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液PH随加入碳酸钠溶液体积的变化曲线如下图所示。
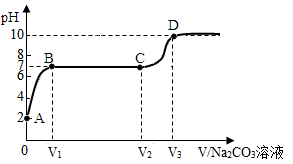
请回答下列问题:
(1)A点处溶液中的两种溶质是(写化学式);
(2)AB段可观察到的实验现象是 ;
(3)BC段发生反应的化学方程式是 ;
(4)CD段PH上升的原因是;
向100g硫酸铜溶液中,逐滴加入
溶液,加入
溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题:

(1)将
点所对应的混合物过滤,滤液中所含溶质为;
(2)图中
点所对应的溶液总质量为g;
(3)求(1)中所得滤液的溶质质量分数(请写出计算过程)。
我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25
样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示。

(1)求样品中碳酸钙的质量分数;
(2)所加稀盐酸的溶质质量分数.
工业制取碳酸钠常会含有少量的氯化钠.实验探究小组欲测定碳酸钠样品中碳酸钠的质量分数,取该样品11
加入64.4
水形成不饱和溶液,然后向其中加入一定量的稀盐酸,恰好完全反应,所得溶液的溶质质量分数10%。产生二氧化碳的质量与时间的关系如图所示:
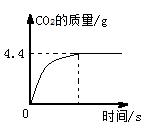
(1)求该样品中碳酸钠的质量分数.(结果精确到0.1%)
(2)求恰好完全反应时所加稀盐酸的质量.
现有在敞口容器中放置的氢氧化钠固体,分析得知含水6.62%、碳酸钠2.38%、氢氧化钠91%。将此样品1 放入烧杯中,然后向其中加入46克溶质质量分数为3.65%的稀盐酸,过量的稀盐酸用溶质质量分数为4.43%的氢氧化钠溶液恰好中和,用去氢氧化钠的溶液20.5 。蒸干中和后的溶液,可得到固体的质量为 。
高铁酸钾(
)是一种集吸附、凝聚、杀菌等多功能的新型、高效能水处理剂。198℃以下时能稳定存在,但受热易分解(
)、遇水将变质(
)。根据要求回答下列问题:
(1)取等质量的两份高铁酸钾固体分别加热、与水反应,请通过观察上述化学方程式,判断充分反应后产生氧气的质量(填"相等"、"不相等"或"无法确定")。
(2)为检测实验室新买的高铁酸钾固体样品中高铁酸钾的质量分数,某同学取10g样品进行实验,共收集到氧气0.96g。试通过计算求该样品中高铁酸钾的质量分数。
(已知:
的相对分子质量为198)
某化学实验小组加热15.5gKClO3和MnO2的混合物制取氧气,完全反应后,称得固体剩余物质量为10.7g。请计算:
(1)生成氧气的质量为克。
(2)小组同学从剩余固体中提纯出KCl固体(提纯过程中药品无损失),欲将其配制成溶质质量分数为10%的KCl溶液,需加多少克水?
某小组欲用4.9%的稀
测一瓶标签破损的
溶液的质量分数.

(1)从一瓶标签模糊的
溶液里取出几滴后向(填写溶液名称)里滴加,呈红色.
(2)取
溶液样品,并与4.9%的稀硫酸溶液混合.由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为。
(3)求
溶液样品中溶质的质量分数.
取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的
溶液,产生沉淀质量与滴入
溶液质量的关系如图所示。
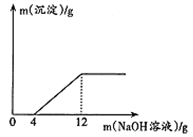
(1)滴入
溶液的质量在0~4g时,发生反应的化学方程式为;
(2)与氯化铜反应的
的质量为g;
(3)原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
某氢氧化钙粉末中含有碳酸钙杂质.现取样品15g于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
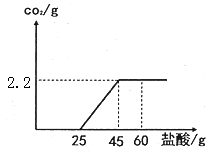
(1)生成二氧化碳的质量是g;
(2)加入60g稀盐酸后所得溶液中含有的溶质是、(填化学式);
(3)计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).
某补钙药剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与40盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6
,请回答下列问题(计算请写出过程):

(1)青少年缺钙易出现的疾病是;
(2)该品牌补钙药剂每片含
的质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)
工业上用电解
溶液的方法来制取
、
和
,反应的化学方程式为:
.现取一定质量分数的
溶液87.3
进行电解,当
完全反应时,生成0.2
。
(1)当
完全反应时,生成
的质量为,参加反应的
的质量为。
(2)当
完全反应时,所得
溶液中溶质的质量分数为多少?(假设生成的
和
全部逸出)(要有计算过程)
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),完成下列问题:

(1)该反应产生的
气体质量为g。
(2)计算反应后所得溶液中溶质质量分数(写出计算过程)
某实验小组为了测定某混合物(
与
)中碳酸钠的质量分数,进行了如下实验:称取
样品配成溶液,然后逐渐加入一定量的质量分数为
的稀盐酸,充分反应.在此过程中 进行了
次数据测定,所加入稀盐酸的质量和生成的气体质量如下表:
| 测定次数 |
|||
| 加入稀盐酸的质量 | |||
| 生成气体的质量 |
请分析数据,回答下列问题:
(1)第1次测定数据时所得溶液中含有的溶质有。
(2)混合物中碳酸钠的质量分数是。(计算结果精确到
)
(3)计算第
次测定数据时,反应所得溶液中氯化钠的质量分数。(写出计算过程,计算结果精确到
)
黄铜是一种常见的合金材料,其作用成分为
、
,还含有少量不与酸反应的成分.现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生
的质量和硫酸溶液体积的关系如图所示.充分反应后溶液中剩余固体的质量为27g。

(1)观察图象,黄铜与硫酸充分反应后,硫酸是否有剩余?(选填"是"或"否")
(2)黄铜中
的质量分数为多少?(请列式计算,结果精确到0.1%)
(3)若往反应后的溶液中滴加26%的
溶液至恰好不再产生沉淀时,共消耗
溶液400g,则原硫酸溶液的质量分数为多少?(请列式计算,结果精确到0.1%)